1. 背景
在过去的十年中,金属有机框架(MOFs)已被报道用于多种应用,包括气体分离/吸附、光电子、传感、能源相关应用、催化、膜技术和药物输送。在药物输送领域,一些用于肿瘤药物输送的材料正在进行临床试验。这种网状化学的发展导致了一种新的晶体多孔材料家族的产生,称为共价有机框架(COFs),它完全由有机支架组成,不含金属离子。这一领域出现于2005年,近年来蓬勃发展。
COFs由碳、氢、氮、氧、和硼或硫等非金属元素组成,这些元素通过强共价键连接在一起,形成2D/3D晶体周期结构。由于有机合成的广泛多样性,COFs可以产生具有各种结构的有前途的材料,实现结构到功能的应用。与mof类似,COFs也被广泛应用于气体物质的分离、化学和生物识别、多相催化、光电子、能量存储和转换、传感、光热和光动力治疗等领域。
COFs 在医学中的应用 :在聚合物体系中,COFs是生物医学应用的新兴候选人,因为:(a) 它们的模块化和可调结构,可用于荧光成像或与目标结构结合,(b)固有孔隙,可用于上传客体分子,如药物分子;(c) COFs的结构几何参数和拓扑结构可以调整,使COFs具有多种光学特性的有趣材料,这些特性无法与其单体分开使用,**终可以为成像和治疗方面提供额外的特性。(d)与MOFs相比,COFs本质上不含金属,因此没有金属离子浸出引起的潜在生物毒性方面的担忧。
COFs可以拥有2D或3D架构。大多数报道的结构本质上是二维的,由共价键连接在一起的二维纳米片组成这些纳米片通过非共价π π相互作用堆叠。COFs的拓扑结构和几何形状可以根据其单体(包括官能团)的分子几何形状来预先定义。,COFs可以通过控制其单体的空间维度来进行2D/3D空间位置的控制,这是COFs优于非晶聚合物的优点. **COFs的常见方法和时间历程如图1所示
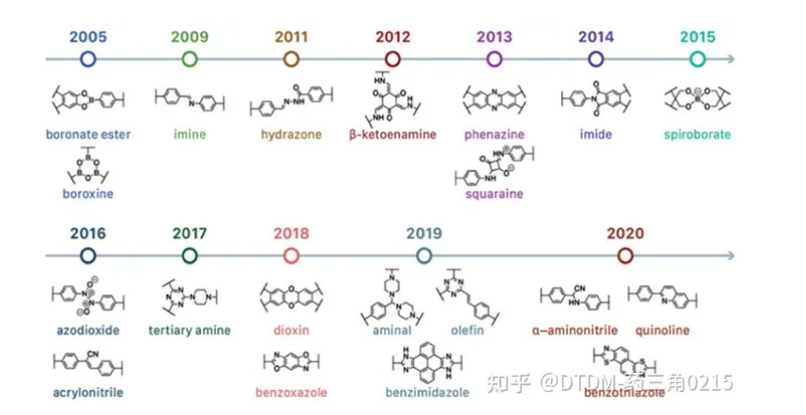
图1. COFs 合成和发展时间轴
COFs的合成有以下几种方法:(a)离子热法,(b)机械化学法,(c)微波法,(d)溶剂热法,(e)常压液相合成,(f)声化学法。
离子热合成是指在离子液体中合成COFs,离子液体是室温下的液体,是一类有机盐类。离子液体作为传统挥发性有机溶剂的替代品,具有环境友好性,具有广阔的工业应用前景。
挤压、剪切和摩擦等机械力/能量可以作用于物质,通过形成新的化学键导致分子发生化学变化,这被称为机械化学。随着机械技术的发展和越来越多地使用研磨和球磨仪器,这些通用的过程已被用于通过机械化学途径合成不同的化合物。在机械化学合成COFs的情况下,应用不同的机械工艺,如成型和使用砂浆、挤出机、球磨机和/或3D打印机。事实上,机械化学合成几乎不需要溶剂,使其成为一种更环保的合成途径。另一种方法是微波合成,采用微波辐射/加热,在短时间内加热稳定,不需要任何热传导。的确,与传统的加热方法相比,微波反应速度更快,效率更高,从而节省了时间。
溶剂热法是合成COFs**常用的途径。**,大多数COFs都是使用这种途径合成的,在这种途径中,反应在一定温度下在密封容器内进行,通常温度是升高的。这通过溶剂的自压力在密封容器中产生增强的压力,**终得到再结晶的材料。通常,一个内衬聚四氟乙烯(PTFE)的容器被放置在一个不锈钢容器内,连同一个厚壁的耐热玻璃管,也可以用来维持升高的温度。合成后,将粗粉用有机溶剂洗涤几次,然后在真空下干燥。尺寸较大/较大的聚四氟乙烯衬垫也可用于大量材料的合成。
常压液相合成是在常压和室温下进行的,这是Zamora等人首次报道的,其中1,3,5-三(4-氨基苯基)苯和苯-1,3,5-三乙醛在DMSO中搅拌48小时,得到粉状产品。这为大规模生产开辟了新的方向。
声化学方法是制备COFs的另一种方法,包括使用声波来合成它们。根据合成所使用的功率,结构可以变化。在少溶前体的情况下,这种方法是有用的。Ahn等人报道了通过改变1,4-苯二硼酸和2,3,6,7,10,11-六羟基三苯之间的声纳功率来合成多功能COFs的声化学方法。
对于特定靶标的生物医学应用,COFs支架需要多种功能位点。有利的是,COFs可以通过功能化进行修饰,可以采用以下两种方法:(i)合成前修饰:在前体合成之前进行修饰,即pre-SM;(ii)合成后修饰:在COF支架合成之后进行修饰,即post-sm。在pre-sm的情况下,在单体中引入官能团,可用于制备功能化的cof。然而,由于合成途径的限制,并不是所有类型的COFs都可以用这种方法制备,从而限制了其利用。在post-sm的情况下,COFs可以通过保持面向目标的锚定基团不受合成后修饰的影响来合成。合成后,可根据目标对同一基团进行修饰。在某些情况下,如果修饰的目标分子比孔大,那么只能进行表面修饰/功能化。这一过程的示意图如图2所示
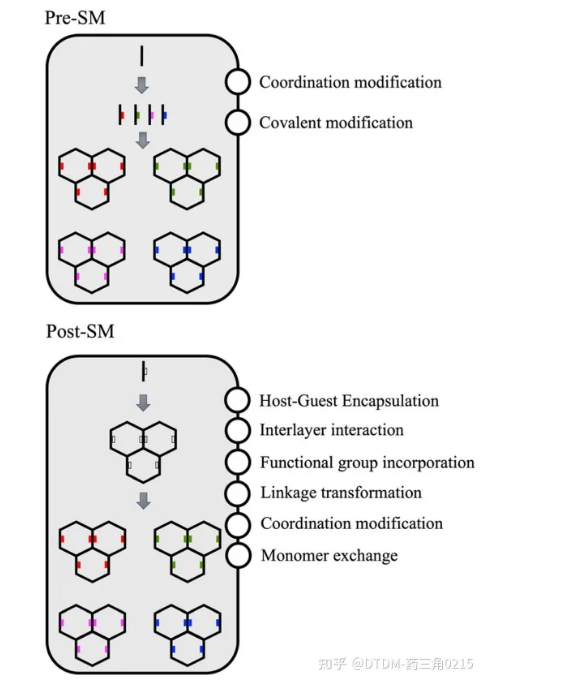
图2 . COFs的多种功能化:Pre-SM 和 Post-SM
COFs易于合成和多功能化使其具有广泛的应用。COFs的新兴应用之一是在生物医学领域,其中**好的想法之一是药物封装/解封装。一些药物分子存在生物稳定性低、肿瘤靶向性差等问题,利用靶向性COFs作为递送货物可以克服这些问题。COFs在生物医学领域的另一个应用是光动力治疗(PDT),这是一种微创治疗方法,在COFs中加载多功能光敏剂。随后,它们吸收光,通过氧的激发形成活性氧,**终导致癌细胞死亡。另外,光热疗法(PTT)是COFs的另一个重要应用,其中COFs中的光热剂吸收近红外范围内的辐射。光热剂的激发态能量通过非辐射松弛以热的形式散失,**终使细胞温度升高而破坏细胞。因此,本文就该领域的研究进展作一综述。
脂质体、二氧化硅、mof和多孔碳基纳米颗粒已被报道为药物载体。脂质体是可溶性和/或可生物降解载体的一个例子,它们在应用后分解,其中它们的亲水头部对准超分子结构的内部和外部以及由它们的疏水尾部组成的膜的内部。脂质体的直径一般为100-200nm。使用生物相容性聚合物如聚乙二醇可以提高循环时间,导致更大的生物利用度。二氧化硅具有高表面积体积比,这使得表面改性,同时保持高孔隙率。**,多种药物的体外和体内递送都已实现。mof是一种高度有序的结构,具有永久孔隙和大表面积。它们是由配体与金属离子/簇通过配位键组装而成的。它们有一个具有化学性质的可调支架,这种高度有序的结构,使它们的化学性质能够控制。因此,mof已成为肿瘤药物输送和应用的合适候选者,目前正在进行临床试验。通常通过热解合成的多孔碳基纳米颗粒也可用于药物递送,因为它们具有高表面积和物理化学性质。介孔碳纳米材料将近红外光转化为热的能力促进了其在联合光热治疗和化疗中的应用。
尽管使用不同的药物载体取得了很大的进展,但它们仍然表现出一些缺点,如下:(a)从载体中浸出有毒物质,例如金属离子,(b)合成繁琐,(c)缺乏化学稳定性,(d)功能途径复杂,(e)药物释放不受控制。因此,只有少数被用于临床试验。在这方面,基于cof的递送系统可以应用于纳米医学的许多领域,因为它可以克服以下几个挑战:(a)易于调节的形态,导致高表面积和孔隙度;(b)由于缺乏金属而具有良好的稳定性,导致低密度结构;(c)在生物样品/介质中具有更好的分散性;(iv)易于细胞摄取和(v)可控释放。
COFs的高可调表面积和明确的多孔结构使其可用于药物递送。此外,它们的有机构建块的易于功能化将有助于在形状-尺寸-表面性质方面定制孔隙,从而增加Π–Π, CH–Π,H键与客体药物分子相互作用的范德华力的机会,这将有助于提高Drug-COF加合物的稳定性。此外,具有轻质元素的COFs的有机骨架使其比mof更适合用于药物递送。在预期递送之前药物浸出是许多药物载体的另一个问题,因为在表面吸附的情况下很难防止浸出;然而,它可以通过孔隙通道封装使其**小化。总之,COFs可能优于当代药物载体。
2. COFs 对阿霉素递送给药
自20世纪60年代以来,从peucetius链霉菌中提取的阿霉素(DOX)已被用作*生素和化疗药物。在结构上,它是蒽环类化疗药物的一部分。DOX可用于治疗实体瘤、软组织癌、甲状腺癌、膀胱癌、卵巢癌、乳腺癌、肺癌、不同类型的白血病以及骨肉瘤。在铂类化疗失败的患者中,经FDA批准,DOX可以插入DNA碱基对,从而导致DNA链断裂。DOX可通过抑制拓扑异构酶II引起DNA损伤导致细胞凋亡。每隔21天静脉注射一次。为了减少输液反应的机会,可以进行脂质体制剂的缓慢给药。它在组织中分布迅速,消除半衰期为48小时。DOX在盐水中的稳定性相对较低,溶液必须避光。因此,考虑到这一点,DOX的控制递送是非常重要和必要的。
2.1
Xi, Huang and Jia报道的COF框架是通过姜黄素衍生物的自组装得到的,然后用聚乙二醇(PEG-CCM)对其进行重组,COF-1被胺(APTES-COF-1)功能化,称为polymer-COF 纳米复合物(PEG-CCM@APTES-COF-1)。它形成了胶束结构,其中有机相是用APTES-COF-1形成的,表面活性剂是用PEG-CCM制成的。采用不同尺寸的PEG-CCM加合物PEG350-CCM、PEG1000-CCM和PEG2000-CCM制备一系列COFs,分别为PEG350-CCM@APTES-COF-1、PEG1000-CCM@APTES-COF-1和PEG2000-CCM@APTESCOF-1。PEG修饰的APTES-COF-1有利于其在水中的分散,DLS分析显示PEG350- CCM的粒径为20 (±5)nm, PEG1000-CCM的粒径为30 (±7)nm, PEG2000-CCM的粒径为45 (±10)nm。其中PEG2000-CCM@APTES-COF-1的荧光强度**高。
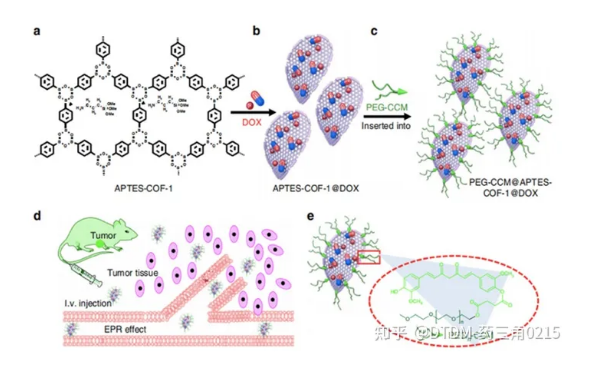
图3. PEG-CCM@APTES-COF-1的DOX负载合成及靶向给药小鼠效果
事实上,荧光测量证实,负载dox的COFs主要积聚在小鼠的肺和肝脏,皮下注射导致其积聚在肿瘤组织中。在小鼠的肾、脑、脾和心脏中观察到轻微/轻微的积累。有趣的是,注射24小时后,肿瘤组织中PEG2000-CCM@APTES-COF-1和dox负载PEG2000-CCM@APTES-COF-1的含量高于其他器官。在COFs中,负载dox的PEG2000-CCM@APTES-COF-1在肿瘤细胞中表现出更高的递送能力。24 h后,负载DOX的PEG2000-CCM@APTES-COF-1在肿瘤组织中的荧光信号分别比PEG350- CCM@APTES-COF-1、PEG1000-CCM@APTES-COF-1、PEG2000-CCM@APTES-COF-1和游离DOX高1.7倍、1.8倍、1.6倍和8.3倍。事实上,载药的COFs被细胞内化,暴露于细胞的酸性隔室时可以释放药物。在载药COFs和游离DOX中,PEG2000-CCM@APTES-COF1@DOX表现出**好的肿瘤抑制效果(图3)。
2.2
Pang和Lin等人报道了通过1,3,5-三(4-氨基苯基)苯(TAPB)和2,5-二甲氧基对苯二醛(DMTP)在室温下缩合反应合成一种用于递送DOX的COF,命名为TAPB-DMTP-COF。在合成COF的过程中,药物被加载,DMTP和DOX搅拌1小时,然后为了完成反应并得到所需的产物,加入TAPB形成所需的DOX@COF。ttap - dmtp -COF的表面积为1000 m2 g1,孔径为3.298 nm,在COF中原位加载DOX后减小。通过UV-Vis分析,DOX@- COF中DOX的负荷量约为32.1%。在卸药过程中,40%的DOX在pH 7.4条件下在前2小时内释放,而在pH 5或6.5条件下,大部分药物在前2小时内释放。观察到,在pH 7.4时,DOX@COF的形态在2h内由球形变为不规则块状。这表明希夫碱基团在PBS中被降解。通过降低pH值或增加反应时间,DOX@COF被完全破坏,**终药物被释放。但仍有必要进一步了解COFs在它们降解成小份后,是否有毒。
2.3
也有报道磺化微孔有机网络的三壳空心球(TH-SMON)和双壳SMON空心球(DH-SMON)的制备,用于高效递送DOX。报道指出单壳中空SMON (H-SMON)的合成是通过1,4-二碘苯和四(4-乙基苯基)甲烷在硅球表面的Sonogashira偶联形成MON(微孔有机网络),然后蚀刻,然后表面磺化。另一种合成方法,首先引入咪唑酸分子筛框架(ZIF-8),然后采用与H-SMON相似的方法,对ZIF-8进行蚀刻和磺化,得到DH-SMON作为一种水相容性材料。重复该过程以提供TH-SMON。采用SEM/TEM对COFs进行形貌分析。H/DH/TH-SMON的平均直径分别为B220 nm、B300 nm和B380 nm。经DOX处理后,H/DH/TH-SMON的负载效率分别为83%、89%和95%(1%)。在pH为7.4的PBS培养基中,在37℃下完成DOX的卸载。7天后,观察到COFs的DOX释放量(即H/DH/TH-SMON)分别为载药量的62%、80%和92%。用MCF-7细胞检测了DOX的递送性能,其中DOX/TH-SMON显示,在100 mg mL1负载下,DOX的递送增加,癌细胞存活率仅为38%(图4)。因此,外壳数量的增加提高了癌细胞的药物包封/解封效率。
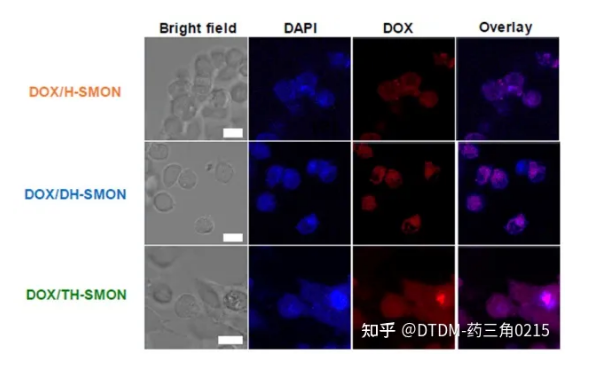
图4. 负载DOX的HSMON、DH-SMON和THS-MON处理MCF7细胞系1小时的共聚焦图像
2.4
Zhang和他的同事们研究了聚乙二醇化氧化还原反应的纳米级COFs,以有效地在细胞中加载/卸载DOX。通过苯1,3,5-三乙醛和4,4’ -二硫代二苯胺之间的席夫碱形成COFs,然后将含二硫的COFs (SS-COF)和Pluronic F68自组装生成F68@SS-COF纳米载体。SS-COFs的表面积为672 m2 g1,孔径分布较窄,为B2.3 nm。通过在pH为5的PBS中引入10 mM GSH,氧化还原反应性COF完成了DOX的卸载,而非反应性COF (F68@nCOFs)没有表现出令人满意的药物卸载。同样的趋势在HepG2细胞中观察到反应性和非反应性载药COFs的递送。然而,载药F68@SS-COFs的IC50值为B3.62 mg mL1,与游离DOX相比(IC50-DOX = 1.78 mg mL1)升高。通常,二硫键会在低pH介质中打开/还原,因此了解COFs在酸性介质中的结构,即在pH为5的PBS中加入10mm GSH,仍有待探索。
2.5
Liu等研究了pH响应共价有机聚合物(cop)。以4,4’-三亚甲基双哌替啶和丙烯酰中四(羟基苯基)卟啉为原料合成了天然可生物降解的b-氨基酯(THPP-BAE-PEG)。采用聚乙二醇(PEG)制备聚乙二醇(PEG)壳,对反应进行淬灭,得到壳状支架。发现该材料具有球形形貌,其平均直径为30 - 40 nm。pH 6.0时,PBS培养基中DOX的脱囊率高于pH 7.4,表明BAEs支架在低pH培养基中降解。随后,在4T1荷瘤Balb/c小鼠中研究了COF-DOX作为化疗-光动力药物的联合应用,该药物使肿瘤生长减少。
2.6
Gong和Liu等报道了高荧光COFs,显示了视觉药物加载和ph反应卸载。该体系是由π-π共轭的三(4-甲基苯基)胺单体与联苯胺反应生成的。用不同的光谱技术对化合物进行了研究,以确保COFs和COFs的形成,SEM数据表明,这些多孔COFs的平均尺寸约为200 nm。制备的COFs具有亮蓝色发光。DOX被装入COF与DOX之间的π-π相互作用和丰富的氧基容易形成氢键相互作用促进了COFs的形成。此外,DOX-COF耦合产生FRET,其中COF可以淬灭DOX的排放。**大载药量为B35%。在酸性条件下(pH b5)获得有效药物释放,据报道,72小时后,与中性条件相比,COF + DOX在A549细胞中的细胞摄取测定显示,共聚焦显微镜和流式细胞术显示,药物(在癌细胞环境下释放)在细胞质和细胞核中的清晰分布。单独的COF对癌细胞的毒性较低(根据MTT试验),而0.375 mg mL1的COF + DOX杀死了几乎80%的癌细胞。此外,发现COF + DOX具有有效的*肿瘤细胞迁移特性。
2.7
Tang等人研究了一类新的COF系统(TpDh),称为核酸门控COF纳米系统,用于癌细胞特异性成像/药物卸载。在这种情况下,卟啉COF纳米颗粒(NPs)装载了DOX货物。在dox负载的COF表面,cy5标记的单链DNA(ssDNA)被吸附。利用Cy5和DOX卸载的荧光来检测肿瘤细胞中释放的ssDNA。在完整的情况下,Cy5荧光通过FRET被COF-DOX加合物猝灭,在特异性TK1 mRNA靶释放后可检测到。COF纳米颗粒对药物(DOX)的载药量为0.330 mg ml / 1,对ssDNA的载药量为0.97 nmol mg / 1。体外药物卸载分析表明,在生理pH下,加合物的药物卸载量不到2% (drug@COF)。在MCF-10A(正常细胞)和MCF-7(癌细胞)细胞上观察药物填充后COF的显像和药物卸载情况。MCF-7细胞中DOX和Cy5均可见高荧光信号,但MCF-10A细胞中未检测到信号,与相应的共聚焦图像一致。流式细胞术分析也证实了这一结论。COF的合成示意图如图5所示
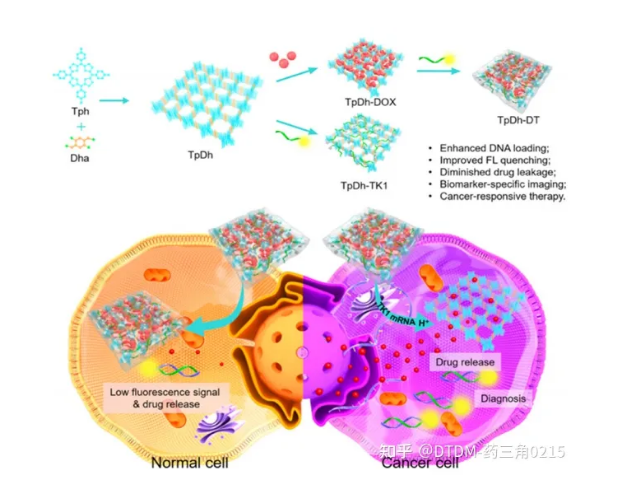
图.5 TpDh合成的示意图,癌细胞的成像和治疗效果
2.8
Wang等人报道了通过5,15-双(4-硼苯基)-卟啉和2,3,6,7,10,11-六羟基三苯共缩合反应制备二维COFs (TP-Por)。为了解决COF的水不稳定性,使用了菁氨酸IR783,这也是一种潜在的治疗药物。在不同质量比的水溶液超声剥离条件下,将COFs与商用IR783混合合成纳米复合材料(COF@IR783),其平均直径为~ 320 nm。通过TEM、SEM、FT-IR和固态核磁共振分析了预期COFs的形成。非局部密度泛函理论(NL-DFT)计算表明COF@IR783的孔径分布为~ 0.65 nm。此外,将前药顺式乌头酰阿霉素(CAD)成功加载到纳米复合材料中,在PBS缓冲液中生成COF@IR783@CAD, 24 h后发现前药在PBS中的卸载率为~ 48.2%。通过流式细胞术和4T1细胞共聚焦显微镜检测COF@IR783@CAD的细胞摄取。众所周知,细胞表面带负电荷;因此,带正电荷的实体可能更容易穿透细胞,然而,作者认为纳米复合材料上的负电荷有利于有效的细胞渗透性。在碘化丙啶染色研究中发现,IR783联合*肿瘤药物递送(通过808 nm激光照射5分钟)在细胞活力方面**有效。激光联合治疗COF@IR783@CAD显示出对小鼠肿瘤生长的抑制作用。
2.9
Anbazhagan等人报道了利用2,5-二(甲基磺酰基)-1,4-二叠氮苯(BMS-DAB-N3)和1,3,5-三乙基苯(TEB)之间的点击化学反应,制备了一种新型的硫醚端三唑桥的共价有机骨架(TCOF)。采用多种光谱技术对TCOF进行了表征,发现其孔径为10 ~ 30nm。聚乙二醇化是在合成后进行的,然后用作*癌药物传递系统。TCOF的表面积为58.871 m2 g-1。TCOF-DOX-PEG,即负载dox的TCOF-PEG,是由静电(π π)和氢键相互作用形成的。药物释放研究在pH为7.4的PBS培养基中进行,其释放率仅为20%,而在pH为5(溶酶体癌环境)和GSH环境下,72 h内载药物的脱囊率接近70 - 80%。TCOF-DOX-PEG与15 mg mL-1载药COF孵育时,杀伤HeLa细胞的能力仅为56%,这表明了DOX在HeLa细胞中的缓慢释放和TCOF-DOX-PEG的内化作用。
2.10
Zhou等人报道了合成以二硒和亚胺为基础的COFs来递送DOX。5,10,15,20-(四-4-氨基苯基)-卟啉(Por)与4,40 -二乙烯二苯甲醛(dis)通过席夫碱反应共聚制得COF-DiSe -Por,并用TGA、TEM、FT-IR和XRD等分析技术对其进行了表征。结果表明,BET表面积为73.5 m2 g-1,当DOX添加量为35.12%,质量比为1:2(料药比)时,BET表面积减小至7.9 m2 g-1。孵育96 h后,pH值为7.4时,DOX释放量为27.9%,pH值为6.5时释放量为42.4%,pH值为5.5时释放量为61.3%。在细胞内化后,细胞内的酸性pH和GSH使C=N和Se-Se键断裂,**终帮助药物释放。Se - Se键的断裂诱导ROS的产生,打破细胞氧化还原平衡,加速细胞死亡。808 nm近红外激光照射6 min作为药物释放的刺激。在GSH、pH和光的共同作用下,DOX的释放量达到89.6%。在这种情况下,降解的COF支架的副作用,特别是细胞对硒基支架的反应还有待深入的研究。
3. COFs对5-氟尿嘧啶(5-FU)的递送给药
5-FU是一种*代谢药物,用于结肠直肠癌、上呼吸消化道鳞状细胞癌和乳腺癌的多种医学治疗。一般来说,*代谢化合物通过抑制基本的生物合成过程或将自身结合到生物大分子(如RNA和DNA)中来起作用,从而阻碍正常的细胞功能。5-FU在这两方面都具有很强的*癌能力。细胞渗透/内化过程与尿嘧啶一样迅速,然后5-FU在细胞内环境中转化为几种活性代谢物。5-FU能抑制核苷酸合成酶胸苷酸合成酶(TS)。然而,5-FU药物在二氢嘧啶脱氢酶(DPD)作用下失去活性,DPD将5-FU转化为二氢氟尿嘧啶(DHFU)。DPD抑制剂,如烯尿嘧啶和5-氯二氢嘧啶(CDHP),被检查调节该药物的活性。总的来说,5-FU的输送对治疗癌症有显著的影响。
3.1
Zhao等人报道了通过改变胺的数量,通过醛和胺的缩合合成COFs,即PI-3-COF和PI-2-COF,其中3表示三胺,2表示COF结构中的两胺。PI-3-COF的BET表面积为1000 m2 g-1, PI-2-COF的BET表面积为1700 m2 g-1。由于5-FU作为*癌药物的效用,它被用作递送的靶向药物。考察裸COFs、5-FU和药物包封COFs (5-FU@PI-2/3-COF)的细胞活力。以200 mg mL-1的浓度与COFs孵育24 h后,裸COFs的存活率达到80%以上。与5-FU@PI-3-COF相比,5-FU@PI-2-COF培养的MCF-7细胞活力较低,说明PI-2-COF具有更强的药物包封能力。用共聚焦显微镜观察5- fuencapsulation COFs是否可以通过内吞途径内化。通过共聚焦显微镜分析,未处理的细胞没有荧光,而5-FU@PI-2-COF/ pi -3- cof处理的细胞的蓝色发射表明5- fucof加合物进入了细胞(图6)。
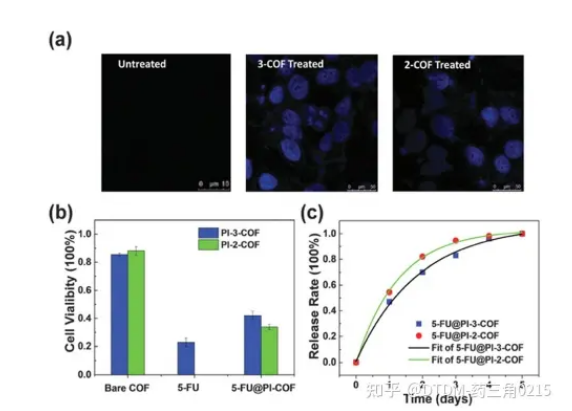
图.6 (a)加载或未加载5fu的COF处理的细胞共聚焦图像,(b)细胞活力分析,(c)从包封的COF中卸载5-FU
Hashemzadeh等人使用同样的PI-3-COF对5-FU的吸附进行了量子力学和分子动力学研究。在初步阶段,采用离散傅里叶变换对5-FU的几何参数进行了研究。量子力学分析表明,药物吸附加合物是稳定的,过程是放热的。π键和氢键相互作用稳定了5FU-COF加合物。从自然键轨道分析可以看出,电荷从COF转移到5-FU,从分子动力学可以看出,5-FU扩散到COF孔是一个缓慢的过程。
3.2
Banerjee等人报道了通过希夫碱缩合法制备TpAPH和TpASH共价有机纳米片作为二维多孔有机高分子材料。随后,对TpASH进行了三次合成后修饰,制备了TpASH-FA(叶酸偶联TpASH)。该化合物用于靶向递送5-FU至MDA-MB-231细胞(乳腺癌细胞的代表)。采用TpASH、TpASH-FA- 5FU(靶向载药探针)和TpASH-APTES- 5FU(非靶向载药探针)在pH 7.4 递送5FU。pH为5.0时,72 h内释药率为74%。采用MTT法测定TpASH的生物相容性,显示其具有生物相容性。生物学分析显示,靶向载药探针(TpASH-FA- 5FU)比非靶向载药探针TpASH-APTES-5FU具有更大的杀死癌细胞的潜力。合成、合成后修饰和给药的示意图如图7所示。
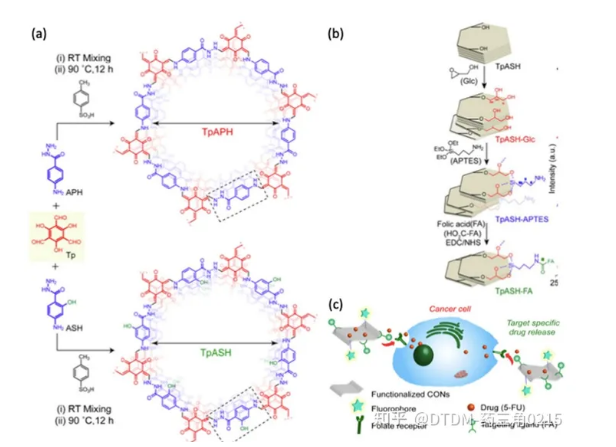
图.7 (a)TpAPH和TpASH的合成方案,(b)修饰-合成后 (c)给药到癌细胞。
3.3
Li和Wang报道了8-羟基喹啉功能化希夫碱COFs的合成,用于5-FU的递送。COF的BET比表面积为80.4781 m2 g-1,孔径为3.7 nm。利用透射电镜(TEM)和傅里叶红外光谱(FT-IR)分析了COF-HQ在水、DMEM/10% FBS和PBS中的稳定性。在pH 7.4和pH 5.0 37℃条件下进行5-FU的卸载,并通过紫外可见光谱进行监测。在pH 5.0时,药物释放量比pH 7.4时高约14%。
4. COFs对布洛芬的递送给药
布洛芬(IBU)是一种广泛使用的非甾体*炎药(NSAID),用于治疗炎症、风湿病和疼痛。摄入后吸收迅速,蛋白结合度高。IBU是一种弱酸,脂溶性,分子量为5 Å 10 Å;因此,它可以穿过细胞膜而不需要特定的转运体。IBU的主要作用机制是抑制COX-1和COX-2环氧化酶,进而直接抑制类前列腺素的合成,这与体内平衡和病理过程有关。它还通过清除炎症过程中产生的活性氧和活性氮(HO·、·NO和ONO-)发挥*炎作用。然而,与其他非甾体*炎药类似,在高剂量时,它可能导致胃肠道和心血管问题。IBU的生物半衰期为2小时,因此它是持续或控制药物递送的潜在候选者。
4.1
Li等报道了设计合成具有菱形平铺(kgd)拓扑结构的多用途微孔二维COFs。以六(4-甲苯基)苯(HFPB)为顶点,以三种不同的三(4-氨基苯基)胺(TAPA)、1,3,5-三[4-氨基(1,1-联苯-4-基)]苯(TABPB)和三(4-氨基苯基)三嗪(TAPT)为边实现了目标拓扑结构。HFPB-TAPA微孔尺寸为B6.7 Å,成功应用于药物载体。HFPB-TAPA的BET表面积为852 m2 g-1,可以在己烷中装载14 wt%的IUB。将ibu负载的COFs浸泡在pH = 7.4, 310 K的PBS中,HFPB-TAPA在5天后卸载99%。此外,HFPB-TAPA在处理大鼠源性H9C2心肌细胞期间观察到低细胞毒性。
4.2
Negishi等人报道了一种合理的设计,通过将棱柱节点(四边形)与方形平面节点连接,生成具有有趣拓扑结构的3D COF (TUS-84)。TUS-84是由C4对称连接剂、D2h对称连接剂、4',5'-双(3,5-二甲基苯基)- 3',6' -二甲基-[1,1',2',1'' -三苯基]-3,3'',5,5''-四乙醛和5,10,15,20-四(4-氨基苯基)-卟啉[8+4]亚胺缩合反应制备的。其比表面积为679 m2 g-1,为双重互穿多孔结构。在正己烷溶液中成功加载了IBU,加载后其BET表面积减小到462.7 m2 g-1。在pH为7.4的模拟体液中,加药后 5 天的TUS-84释药性能为35%,有利于延长给药时间,降低给药频率。他们还报道了卡托普利的装载情况,在相同的条件下,5天内卡托普利的释放率达到98%。
4.3
Chen等人报道了用HAPTP[2,3,6,7,10,11-六(4-氨基苯基)三苯]与几种醛连接,在溶剂热条件下用自模板法制备了不同的COFs,并通过多种显微和光谱技术证实了这一点(如图8所示)。HAPTP-TPA 2DCOFs、HAPTP-TFPB和HAPTP-TFPA 2DCOFs的BET表面积分别为B954.9 m2 g-1、B531 m2 g-1和B829 m2 g-1。将COF浸润在IBU培养基中,然后过滤,用己烷洗涤,得到载药COFs加合物。TGA分析显示,HAPTP-TPA载药量为20%,HAPTP -TFPB载药量为12%,HAPTP-TFPA载药量为13%。考虑到IBU的低溶解度,通过透析和紫外-可见分析监测解封。毒性/生物相容性测试表明,即使在100 mg mL浓度下,COFs的毒性较低。
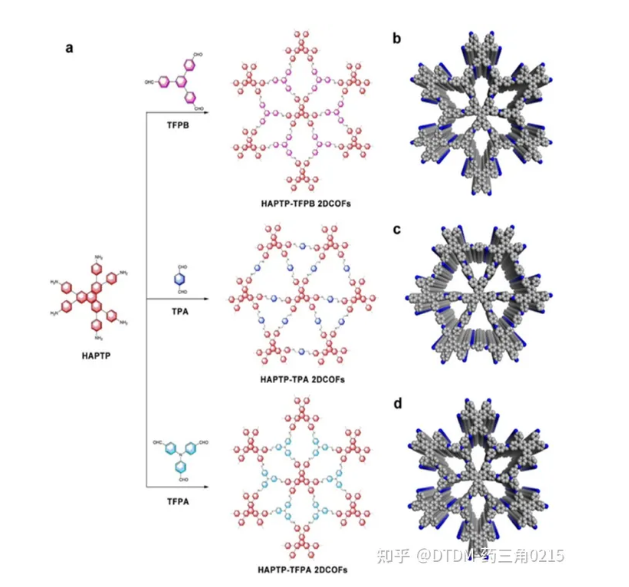
图.8 COFs合成途径示意图。(b-d) COFs的可能三维结构。(颜色代号:灰色,C;蓝色,N。为清晰起见,省略氢原子)
4.4
Qiu和Shan等报道了PI-COF-4和PI-COF-5两种3D COFs的制备。PI-COF-4/5具有一个四面体顶点的菱形网络,该网络是通过亚甲基化将线性单元和四面体单元结合得到的。焦二酸酐(PMDA)与四面体1,3,5,7-四氨基金刚烷(TAA)和四(4-氨基苯基)甲烷(TAPM)反应,分别得到PI-COF-4/5的三维骨架。PI-COF-4的BET表面积为2403 m2 g1, PI-COF-5的BET表面积为1876 m2 g1。PI-COF-4的孔径为13 Å, PI-COF-5的孔径为10 Å。之所以选择IBU作为COF结构中包裹的药物,是因为其空腔足够大,可以吸收IBU分子(图9)。将PI-COFs浸入正己烷溶液中以装载药物,这一点得到了各种分析工具的证实。ibu包封PI-COF-4的BET表面积为1085 m2 g1, PI-COF-5的BET表面积为699 m2 g-1。与PI-COF-4相比,PI-COF-5的孔径较小,因此释放速率较低。通过紫外可见光谱分析测量了药物释放谱,其中PI-COF-4的释放量为60%,而PI-COF-5在12小时后释放量为49%。在加载后6天内,COFs释放了初始封装ibu的95%。这些结果使我们好奇PI-COFs在活细胞/体内系统中对药物递送的生物适用性。
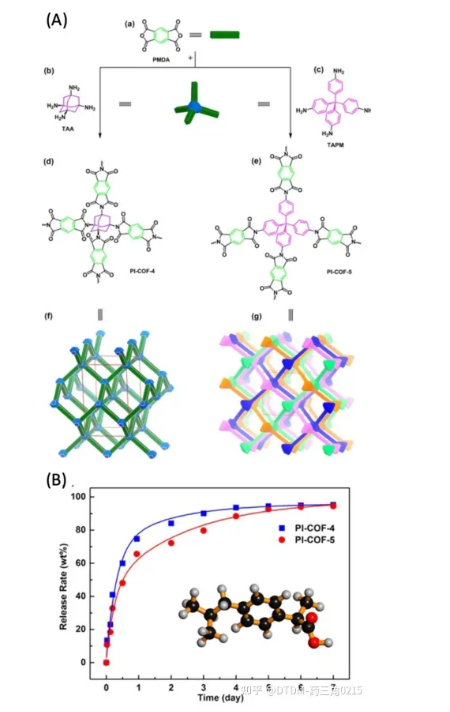
图.9 (A) PI-COFs的合成策略;(a)-(e)非互穿3D框架(f)互穿3D框架(g)钻石网的3D框架 (B) cofs的药物释放概况
4.5
Kumar等人报道了在室温下使用1,3,5-三(4-氨基苯基)苯和1,3,5-苯三乙醛在催化量下以1:1的比例与冰醋酸合成亚胺连接的COFs,并使用不同的光谱技术证实了这一点。将IBU装入正己烷溶液中的COFs中。COFs在室温下用正己烷浸泡72 h,过滤、洗涤、干燥备用。RT-COF-1的BET表面积为468 m2 g-1,载药后减小至117 m2 g-1。卸载在磷酸盐缓冲盐水(pH为7.4)中进行,在37℃下连续搅拌2小时。分析显示溶液中药物释放量约为33%。
4.6
Yu等人通过三角单体三(4-氰atophenyl)-1,3,5-三嗪与氰酸酯连接,合成了NOP-14。二苯基砜中不同量的TCTZ可产生多种COFs,即NOP-14@10%, NOP-14@5%, NOP-14@2%和NOP-14@1%。NOP-14@1、2、5、10%系列的BET比表面积分别为32、144、78和25 m2 g-1。采用MTT法研究COFs的生物相容性。通过浸渍IBU和COFs将IBU装入己烷中,并通过UV-Vis分析监测。采用TGA、PXRD、元素分析等方法对载药量进行分析。N2吸附无残余孔隙,表明COFs孔隙中有药物负载。分别为NOP-14@10 wt%、NOP-14@1 wt%、NOP-14@2 wt%和NOP-14@5 wt%,分别为54.83%、37.06%、38.62%和50.75%。在模拟体液中进行卸载,并使用紫外可见分光光度计进行监测,显示其在8小时内释放。在NOP-14@2 wt%的情况下,50%的药物释放大约需要5小时,而在72小时内,所有药物被释放。
4.7
除Schiff碱型COFs外,Zhu等人还报道了氯氰尿酸与哌嗪一步聚合合成PAF-6的方法。反应**初在冰浴中进行4小时,随后将温度缓慢升高至90℃。PAF-6的形成是通过不同的分析仪器技术,如FT-IR和13C固体核磁共振来证实的。PAF-6的表面积为182.7 m2 g-1,呈二维有序结构,孔径均匀,为11.8 Å。对PAF-6进行MTT试验,发现PAF-6几乎没有细胞毒性。采用PAF-6在己烷介质中加载IBU药物,并在pH 7.4 SBF下监测其释放。完成50%的交付需要近5个小时,而在46小时内,几乎所有的封装材料都被释放出来。药物在活细胞/体内系统中的传递将是值得探索的。
5. COFs对胰岛素的递送给药
糖尿病影响了近10%的人口,自1980年以来发病率翻了两番,使其成为**第七大死亡原因。在1型糖尿病的情况下,它是由胰腺b细胞胰岛不能产生胰岛素引起的,而对于2型糖尿病,产生的胰岛素不能被身体使用。因此,将胰岛素注射到体内是治疗糖尿病**有效的方法之一。口服胰岛素在这方面是一种革命性的方法,因为它的非侵入性治疗调节,没有副作用,例如,自注射疼痛或频繁皮下注射引起的焦虑。有利的是,口服胰岛素可以通过肝脏到达/扩散,这类似于生物合成的胰岛素。然而,注射胰岛素可影响外周高胰岛素血症。口服胰岛素面临的主要挑战是其在胃肠道中的溶解度和/或稳定性、生物利用度等。因此,需要以目标为导向的胰岛素递送。
5.1
Trabolsi等人报道了装载胰岛素的tta - dfp - nCof的制备。据报道,COF的BET表面积为384.5 m2 g1。胰岛素负载由复杂的仪器支持监测,例如,对胰岛素上清溶液进行核磁共振分析,其中1h -核磁共振信号的减少趋势是药物负载的明确证据。采用荧光素异硫氰酸酯(FITC)标记胰岛素,便于荧光光谱法监测胰岛素的卸载情况。COF显示出大约65% wt%的胰岛素负荷能力。通过BET表面积分析监测负载情况,在胰岛素负载后,其表面积从384.5减少到12 m2 g-1,非常显著。胰岛素加载后的PXRD图是平坦的,说明胰岛素加载后,COF层的周期性受到影响,失去了结晶度。胰岛素负荷的减少反映在COF的信号减少,而不是PXRD信号微弱或无信号,这支持了胰岛素负荷导致信号平坦的假设。胰岛素的分子大小为2.5-3 nm, COF的孔径为1.7nm。因此,可以得出结论,胰岛素分子被嵌入到COF层中,而不是内化在COF的孔隙中。在PBS (10 mM, pH 7.4)中分别以不同的葡萄糖浓度0、1、3和5 mg mL-1作为对照、正常和糖尿病状态,检测高血糖触发的药物释放。在对照条件下,12%的药物被释放,表明胰岛素释放缓慢。在高血糖状态下(3 mg mL-1), 100%胰岛素在7.5小时内释放。通过口服途径给药胰岛素负载的COF给药链脲佐菌素诱导的糖尿病大鼠,血糖水平在2-4小时内逐渐持续降低,胰岛素生物利用度高,无全身毒性(图10)。
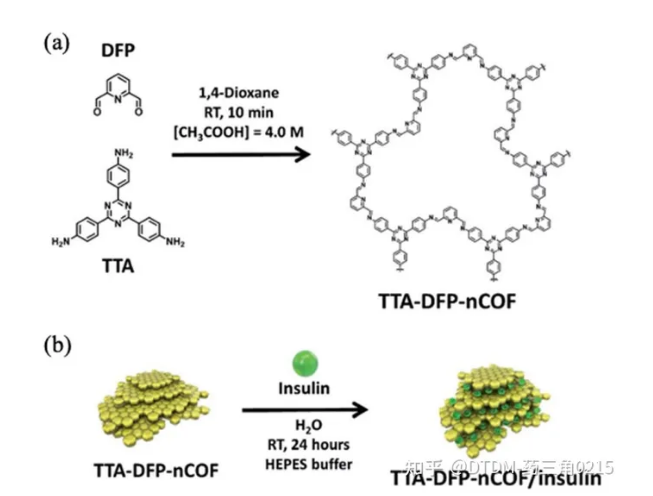
图.10 (a) tta - dfp - nof的化学结构和合成路线;(b)胰岛素嵌入COF的示意图
5.2
Jia和Gao团队报道了通过Lewis/Brønsted型相互作用(N: →B),合成了硼氧联苯COFs,即COF-1 [(C3H2BO)6·(C9H12)1]和COF-5 (C9H4BO2),用于包封葡萄糖氧化酶(GOx)和胰岛素(Ins)。此外,用异硫氰酸荧光素(FITC-PEG)标记的PEG对COFs进行后合成功能化,从而在水介质中形成所需的产物。通过TGA、PXRD、TEM、SEM、CLSM等精密分析工具对FITC-PEG-COF-5@Ins-Gox和FITC-PEG-COF-1@Ins-GOx进行了分析。胰岛素在COFs中的包埋导致其孔体积和表面积的减少;然而,FITC-PEG-COFs尺寸没有发生变化。在葡萄糖浓度高的情况下,葡萄糖通过孔进入COFs。然后它与Gox反应,导致葡萄糖选择性氧化为葡萄糖酸,**终降低pH值,导致支架分解。因此,胰岛素的释放有助于降低血糖水平。A549细胞的细胞成像数据显示,聚合物- cofs被有效吸收,24小时后细胞存活。进一步,在1型糖尿病小鼠模型中研究了聚合物-COF的体内适用性,结果表明COF复合物对高血糖状况有快速反应,并具有监测血糖水平的功能。此外,硼的聚合物- cof复合材料在向A549细胞递送天然蛋白质方面表现出一致的行为。
6. COFs对其他药物的递送给药
基于上述系统的讨论,另一个问题是了解COFs传递其他药物分子的能力,如槲皮素、吡非尼酮、顺铂和伊立替康等。我们搜集了关于几种药物分子被COFs递送的摄取和释放的相关进展。
6.1
Lotsch等人报道了TTI-COF的制备,用于槲皮素(3,3‘,4’,5,7-pentahydroxyflavone)的靶向包封/脱胶囊。采用三嗪三苯基胺和三苯基醛在三甲苯/二恶烷(1:1,v/v)中以1:1的比例制备了TTI-COF,并通过NMR、FT-IR和PXRD等分析工具对其进行了验证。测得BET表面积为2197 m2 g-1。TTI-COF表现出绿色发光,槲皮素的存在使其猝灭,Stern-Volmer常数为1.65 * 10 7 m-1 (Ksv)。在THF培养基中载药16 h,然后过滤/洗涤。BET分析显示,COFs的表面积减少到56 m2 g-1,表明COFs的孔隙被填充。几何优化显示药物分子沿COF孔壁垂直排列,其中药物的多酚性质与TTI-COF的希夫碱氮进行H键相互作用。用人乳腺癌细胞系MDAMB-231细胞检测药物卸载。通过荧光显微镜监测信号,显示药物修饰的COF处理后细胞凋亡。用非癌性人乳腺上皮细胞mcf10a测定了COF的生物相容性.
6.2
Akyuz报道了用于递送卡铂的亚胺基二维COFs的合成。这种分子作为*肿瘤分子被认为是治疗癌症的药物。以1,3,5-三甲基苯(TFB)和3,3‘ -二甲氧基联苯胺(DMB)为原料合成了二维COF。在对COF进行表征后,将其用于卡铂的装载和随后的递送。实验分析表明,该药物在二维COF中的载药量为-30%。卸载实验在(a) pH 7.4和(b) pH 5.0的不同pH介质中进行120 h。结果表明,pH为5.0时,药物卸荷量大于pH为7.4的培养基;这是因为在酸性介质中,药物与COF之间的氢键相互作用变弱(图11)。理论分析了药物与COF分子的相互作用。观察到药物与COF之间形成氢键和CH -π键,形成主客体化合物。
图.11 一些具有代表性的COF支架被用于向靶点递送多种药物
6.3
尽管该领域的大部分工作都集中在针对癌细胞,但Zhang等人的研究小组考虑了细胞外基质(extracellular matrix, ECM),它是由血管、肿瘤细胞和非肿瘤细胞组成的复杂系统阵列。考虑到ECM在药物递送到癌细胞方面的关键作用,该小组开发了一种功能性的基于ZCOF的ECM消耗纳米系统来增强肿瘤PDT。在本研究中,吡非尼酮(PFD)作为*纤维化药物以1[4,4',4''-(1,3,5-三嗪-2,4,6-三基)三苯胺(TTA)]和2[2,5-二羟基对乙醛(DHTA)]为反应试剂制备的希夫碱COF为载、卸药试剂。然后用两亲性聚合物聚(乳酸-羟基乙酸)-聚(乙二醇)(PLGA-PEG)得到PFD@COFTTADHTA @PLGA-PEG,简称PCPP。COF的表面积为2831 m2 g-1,孔径为-3.67 nm。PCPP在pH 7.4的PBS中孵育72 h (3 d)后,其有效药物释放率为-74%。在CT26荷瘤小鼠模型中,PCPP选择性地在肿瘤细胞内积累,并降低肿瘤的转移水平。
6.4
Chatterjee和Bhaumik等人报道了通过希夫碱反应合成TRIPTA-COF。其BET表面积为1074 m2 g-1。随后,TRIPTA-COF装载顺式铂,装载量为31.19%。MDA-MB-231细胞仅接受顺铂和顺铂负载的COF治疗,分析显示顺铂负载的COF对癌细胞的抑制作用高于原始顺铂治疗。顺铂负载的COF被癌细胞内化,可以很容易地在细胞内传递药物,增加顺铂的细胞毒性。在这里,值得一提的是单独的COF对癌细胞的生长基本没有影响;然而,靶向COF包封/介导的顺铂比原始顺铂表现出更好的抑制作用。
6.5
Guan等人报道了用颜料Orange 71合成共价三嗪有机骨架。BET的表面积为960 m2 g-1。考虑到伊立替康(iinotecan, CPT-11)的生物半衰期为6-12 h,我们选择了用于晚期结直肠癌的伊立替康(iinotecan, CPT-11)在共价三嗪有机框架中进行负载。因此,在应用过程中,该药物的控释是非常必要的。在pH为6.8的PBS培养基中,以1:1的比例混合COF和药物进行上样,荧光光谱监测。在pH为5.4、6.8和7.4的三种溶液中进行负载,其中pH为6.8时负载**高。载重量为27.9 wt%。卸载在37℃下进行,缓冲介质的pH值分别为7.4、6.8和5.4。pH为7.4时,24 h和48 h的卸载效率分别为4.8%和21.1%左右。在酸性介质中,pH值为6.8时,48 h后释放率为74.9%,pH值为5.4时,释放率为56.7%。由此可以认为,该探针具有作为pH响应性药物载体的能力。
6.6
Dinari及其同事采用共价三嗪基聚合物(CTPs)作为药物载体。4,4‘,4’‘ -((1,3,5-三嗪-2,4,6-三基)三氮二基)三苯甲酸与3,30 -二氨基联苯胺反应,即BZ-CTP的溶剂热合成方法。据报道,多孔聚合物具有高表面积和热稳定性(在800℃时仅损失样品重量的19.3%)。采用FTIR、元素分析、SEM、TEM和粉末XRD对ctp进行了分析。SEM显微图显示,化合物具有-139 nm大小的球形颗粒,这主要是由于BZ-CPT片间的π-π堆积力所致。此外,BET研究表明,微孔的表面积为-681 m2 g-1。该组以吡罗西康(PRX)和甲氧胺酸(MFA)作为非甾体*炎药,证明了BZ-CTP的药物负荷。这些药物在水中的溶解度很低,导致药物的生物利用度较低,如果长期高剂量使用会产生不良反应。为PRX和MFA找到合适的载体有可能提高它们的效率,并将防止使用有毒的处理剂量。药物(0.1M DMF溶液)加载成功,分别以53%和49%的载药量获得PRX@BZ-CTP和MFA@BZCTP,并采用多种光谱技术对其进行分析。MFA@BZ-CTP和PRX@BZ-CTP在PBS中的体外释放行为表明,在24和96 h内,MFA的释放量分别为-92%和-81%然而,**,该平台尚未在细胞或体内进行研究。
6.7
Dinari及其同事报道了用对羟基苯甲醛和三聚氰尿酸单体单元制备聚亚胺基共价三嗪骨架(PI-CTF)。PI-CTF的表面积为856 m2 g-1。在DMF中完成了前列腺癌药物索拉非尼(SFN)的装载,装载效率分别为83%和98%。在PBS中研究了药物的卸载,当pH从7.4降至5.3时,药物的释放率更高。LNCaP细胞在暴露48和72 h后,使用原始SFN和SFN@PI-CTF的MTT试验研究其体外细胞毒性,两者表现出相似的细胞毒性。
6.8
Chen和同事们报道了通过改变单体或溶剂的浓度来合成具有多种拓扑结构的COFs。采用两种双官能单体,即以联苯为基础的{3,5-双(对氨基苯基)- 3’,5‘ -双[4-(5’‘,5’‘-二甲基-1’‘,3’‘-二恶烷-200基)苯基]-联苯(BABN)和3,5-双(对氨基苯基)- 30,50 -双(4-甲酰苯基)-联苯(BABF)}。在不同溶剂如二氯甲烷或三甲苯溶剂中得到了由六角形/三角形双孔(DP)或具有菱形方形(sql)单孔(SP)支架(BABN-DP)组成的kagome (kgm)晶格。所获得的COF能够分别装载布洛芬和卡托普利药物,并在pH为7.4的模拟体液中监测其释放速度。7天后,BABN-DP COF显示卡托普利释放率为87.6%,而IBU的释放率为62.4 wt。
6.9
Wang等人报道了用对苯二醛和四(对氨基苯基)卟啉反应合成COF-366。BET的表面积为1240 m2 g-1,加入*癌药物plumbagin后,BET的表面积降至560 m2 g-1。紫外-可见验证了载药效率为54.3%。将含plumbagin的COF-366浸入PBS溶液中,并在室温下监测pH为5.5和7.4的递送情况。在pH为5.5时,93%的载药在72小时后被递送,而在pH为7.4时,递送速度较慢。ph控制的递送是由于COF-366的溶解,其中COF-366在酸性条件下被部分破坏,可见其BET表面积在药物卸载后减少到420 m2 g-1。
6.10
他等人报道了OC-COF[一种**佳可生物降解的交联共价环糊精框架]的合成,作为ROS信号干粉吸入器(DPI)载体在急性肺损伤(ALI)治疗中的应用。首先,将g-环糊精(g-CD)修饰为相应的CD-MOF。其次,将g-CD与草酰氯(OC)一锅交联,得到立方形貌尺寸在2 ~3mm范围内的OC-COF。因此,该工艺在COF中引入了ros响应键。OCCOF进一步加入过草酸酯键作为过氧化氢清除剂,它可以水解正常到内溶酶体的pH变化,消除炎症部位产生的ROS,这从引入OC-COF后对H2O2处理的MHS细胞的细胞分析中可以看出。由于其清除H2O2的能力,200 mg mL-1 OC-COF可以保持细胞活力。在WI26- VA4、A549、Calu-3细胞和SD大鼠中也证实了COF的生物相容性。此外,内化的OC-COF是可生物降解,通过肝脏和肾脏代谢排出体外。在OC-COF中引入*炎*氧化药物川芎嗪(ligg)治疗ALI,得到DPI LIG@OC-COF。在ALI大鼠中,吸入五分之一LIG剂量的LIG@OC-COF可明显缓解炎症、氧化应激和肺损伤。
6.11
Jiang及其同事报道了在支架中含有偶氮键的低氧敏感COF的合成。它具有纳米级的尺寸,并配有不同的光敏剂,即缺氧活化药物替拉帕胺(TPZ)和氯e6 (Ce6)。COF以4,4-偶氮二氨基苯(AD)和1,3,5-三甲酰-2,4,6-三羟基苯(TP)为原料制备,并通过几种光谱技术进行了分析。合成的COF的表面积为630 m2 g1,孔径为B2 nm。利用COF完美的结晶度和均匀的孔隙率来负载Ce6和TPZ药物,然后用甲氧基聚乙二醇胺对其表面进行修饰,得到TA-COF-P@CT。肿瘤微环境过度表达偶氮还原酶。因此,为了评估TA-COF-P@CT对偶氮还原酶的体外反应性,将已知的偶氮还原酶仿生化合物Na2S2O4与TA-COF-P@CT在37℃的水溶液中充分混合,使TA-COF-P@CT中TPZ的荧光信号增加了10倍。在4T1细胞中研究了TA-COF-P@CT的细胞摄取,其中TPZ(红色)和Ce6(绿色)的荧光信号在细胞质中共定位。此外,低氧处理后TPZ的信号强度(红色)比常氧处理增加了2.2倍,这确实证明了低氧微环境可能导致TA-COFP@CT的分解和TPZ的快速释放。此外,我们还发现,与TA-COF-P@CT孵育并暴露在光(650 nm, 3 min)下的细胞比没有光照射的细胞显示出更高的荧光输出。(图.12)

图.12 (a) TA-COF和TA-COF-P@CT的合成; (b)通过光激活途径的低氧敏感药物递送
该实验还观察到Ce6在4T1细胞缺氧诱导后增加ROS生成的能力(图13)。在4T1异种移植物荷瘤BALB/c小鼠中也研究了TA-COFP@CT的体内肿瘤靶向能力。在光照下,TA-COF-P@CT小鼠组对4T1肿瘤生长表现出**的抑制作用。肿瘤生长几乎被抑制,考虑到肿瘤质量/大小等参数,TA-COF-P@CT具有较好的*肿瘤效率。为探讨TA-COF-P@CT的影响,对不同脏器进行苏木精和伊红(H&E)染色分析,脾、心、肝、肾、肺等脏器未见明显组织学异常。结果表明TA-COF-P@CT的处理不会对小鼠的正常器官造成任何额外的损伤Gong等人证明了COF是一种有效的癌症饥饿治疗平台。本文报道的COF是用以下前体合成的:(i) TPA-CHO: π - π共轭三(4-甲酰苯基)胺和(ii)联苯胺。合成的COF的表面积为24 m2 g-1,平均孔径为-30 nm。葡萄糖氧化酶(GOx)和l -精氨酸(Arg)在纯水中负载。经Rho B-COF处理后,COF的纳米级形状可以被HeLa细胞内化。在肿瘤细胞中,葡萄糖的分解和葡萄糖酸和H2O2的产生是由GOx催化的。产生的H2O2随后与L-Arg反应生成NO,从而抑制肿瘤细胞增殖。在细胞中,通过4-氨基-5-甲氨基- 2’,7‘-双乙酸二氟荧光素等荧光探针验证了NO的产生,荧光随着COF + GOx + L-Arg(即NO)浓度的增加而增强。作者还通过MTT实验证明了COF的无毒性和COF + GOx + L-Arg的极端细胞毒性。发现细胞凋亡的机制是溶酶体损伤。在带瘤小鼠体内实验结果表明,COF + GOx + L-Arg具有抑制肿瘤和*迁移的作用。
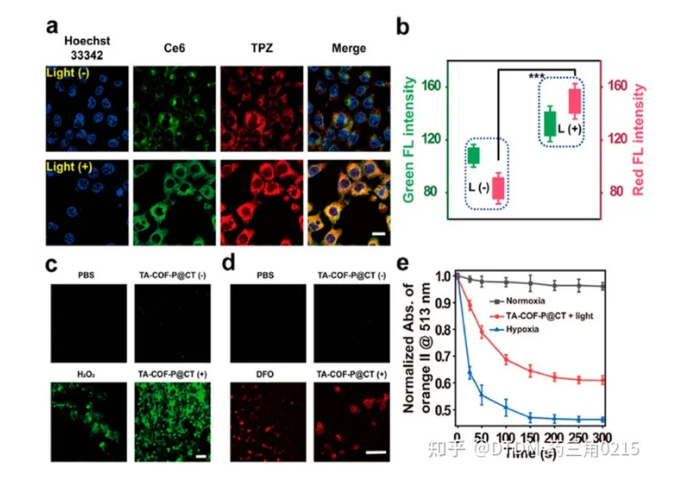
图.13 共聚焦显微镜下的4T1细胞(a) TACOF-P@CT,带灯或不带灯。(b)归一化荧光强度为Ce6(绿色)和TPZ(红色);(c)在有光或无光条件下,用TA-COF-P@CT孵育的4T1细胞识别细胞内的ROS。阳性对照:H2O2。(d)在有光或无光条件下,用TA-COF-P@CT孵育4T1细胞的缺氧识别。阳性对照:DFO(1,8-二氮芴-9- 1);
注:(e)橙II在513 nm处的归一化吸光度。细胞核标记Hoechst 33342。比例尺(a)为20毫米,(c)和(d)为100毫米
6.12
Han和他的同事报道了用黑色素作为模拟血小板支架的卟啉基COFs的制备。核壳melanin@porphyrin-COF (MPC)的比表面积为638.4 m2 g1,孔径为16.4 Å。水蛭素药物被melanin@porphyrin-COF包裹,再用小鼠血小板膜包裹,**终制备HMPC@PM。血小板膜具有血栓寄存特性,制备的HMPC@PM可以靶向血栓区域,随后开启热疗。在近红外光下,这将导致ROS的产生。采用1064 nm体外激光辐射评价HMPC@PM光热效应。将HMPC@PM血块与新鲜血液一起孵育观察溶栓效果,然后激光照射20min,使血栓因溶解增强而破坏。
6.13
也有报道多孔共价三嗪骨架(CTF)的合成以及*癌药物伊马替尼(IMA)的负载。在PBS中进行体外卸载,pH为5.3时卸载量高于pH为7.4。对正常细胞(L929细胞)和癌细胞(K562细胞)进行细胞毒性评价。IMA@CTF在孵育48小时后对癌细胞表现出严重的毒性,但对正常细胞没有毒性。
6.14
Botela等人报道了一种2D-COF的制备,该2D-COF具有合成后修饰的通用性,可获得各种COF类似物。采用HHTP(2,3,6,7,10,11-六羟基水合三苯)和BDBA(苯-1,4-二硼酸)在三甲苯和1,4-二恶烷的介质中以1:1 (v/v)的比例缩合合成COF-5。用2-氨基苯-1,4-二硼酸(BDBN)代替BDBA,对该分子进行重构,得到CF-x (x = 25-100)。在COF系列中,CF-25的BET表面积**高,为1791 m2 g-1。在DCM中摄取*肿瘤药物喜树碱(CPT),并在PBS缓冲盐水培养基中卸载。在不同的细胞系(如HeLa细胞)中也监测了递送,这表明cof药物部分可能在溶酶体中内吞,正如溶酶追踪器所支持的那样。
7. COFs作为多种药物载体
研究人员在试图揭示COFs的多任务处理能力,这可以让人们更好的了解它们单独加载/卸载多种药物的潜力。这种多功能性可以重新构建,并促使我们重新思考在这一当代领域投入更多的研究,以提高它们在更简单,更顺畅的环境中卸载药物的功效。
7.1
Shi等人报道了一种基于笼型支架,即笼-COF-TT,其中(TT =三氨对苯二甲酸)用于输送IBU、5-FU和卡托普利(CAP)。在COF中分别添加IBU、5fu和CAP后,原始COF (672 m2 g-1)的N2吸附等温线分别降至313、256和218 m2 g-1。在pH为7.4的磷酸盐缓冲盐水中,通过紫外-可见光谱法测定药物释放谱。52 h后,IBU-、5-FU-和cap-负载-COF的初始释药量分别为93%、93%和94%。
7.2
Zhai, Zheng, Mi 等人报道了用席夫碱反应合成DF-TAPB-COF和DF-TATB-COF两种氟化COFs,其中DF-TAPB-COF呈球状,DF-TATB-COF呈颗粒状微观结构。氟基团的存在促进了与客体药物分子的氢键,**终导致更高的药物负载。DF-TATB-COF的BET表面积为1720 m2 g-1,计算DF-TATB-COF的BET表面积为963 m2 g-1。将具有降压作用的5-FU和卡托普利(captopril, CAP)装载在COFs中,通过TGA、FT-IR和PXRD等多种分析方法监测。 DF-TAPB-COF 和 DF-TATB-COF分别装载其中一种靶向药物,即5-FU,分别显示69%和67%的载重量。在CAP的情况下,DF-TAPB-COF和DF-TATB-COF的负荷分别为60%和41%。卸载在PBS培养基中进行,温度为37℃,溶液pH为7.4。3天后,DF-TAPB-COF加合物中80%的5-FU的输送量高于DF-TATB-COF加合物。在B16F10细胞中使用罗丹明B染料监测两种COFs的内吞作用,显示它们成功被细胞摄取。
7.3
Wang及其同事报道了一种基于甲氧基共价有机框架(mCOF)的阿霉素(DOX)和喜树碱(CPT)递送系统的制备。具体来说,用1,3,5-三-(4-氨基苯基)苯(TAPB)和2,5-二甲氧基对苯二甲酸(DMTP)制备的mCOF平均孔径为2.25 nm, BET表面积为682.3 m2 g-1。在mCOF中加载CPT后,表面面积从682.3 m2 g-1减小到521.6 m2 g-1 为了实现纳米载体的生物相容性和特异性线粒体靶向,不同的标签,如DSPE-PEG2000-NHS[聚(乙二醇)-氨甲酰二硬脂酰磷脂酰乙醇胺]和DOXHCl反应形成DOX-脂质。然后CPT@mCOF被dox -脂质、双棕榈酰磷脂酰胆碱(DPPC)和胆固醇琥珀酸单酯(CHEMS)包裹成脂质层。在37 1C的PBS (pH 7.4和5.0)中,进行CPT@mCOF、@ dox -脂质药物释放实验观察到pH反应性,两种药物均显著释放。COF@liposome显著增加4T1细胞中的活性氧水平,**终抑制4T1细胞诱导的BALB/c肿瘤生长小鼠模型。
7.4
Fang和Negeshi等人报道了另一种非常有趣和值得注意的COF(TUS-64),他们将5,10,15,20-四基斯(4-氨基苯基)卟啉(TAPP)与2,3,6,7,14,15-六基斯(40 -甲酰苯基)三苯(HFPTP)在120℃下连接3天,在6 M醋酸溶液/1,4-二氧六环/三甲苯(1:3:7,v/v)的溶剂混合物中以2:3的摩尔比合成。其BET表面积计算为1632 m2 g-1。COF用于装载/卸载药物,如(a) 5-FU(*癌药物),(b)溴莫尼定(治疗青光眼),(c)异烟肼(*结核),(d) CAP(*高血压和心力衰竭药物)和(e) IBU。在CAP、溴胺、5-FU、IBU和异烟肼的作用下,原始TUS-64 COF的比表面积分别降至78.4、501.8、378.7、869.3和610.0 m2 / g。37℃时,载药COF保存在半透袋中,浸泡在pH 7.4的磷酸盐缓冲液中。在每个时间间隔,通过UV-Vis分析监测卸载。在CAP的情况下,12小时后,6%的药物被释放,而2天后,大约92%的药物被卸载。在IBU病例中,12小时后的递送率为40%,6天后的递送率为67%。异烟肼24 h释放率为16%,延长10 d释放率为22%。溴莫尼定的递送率约为35%(6天)。5-FU给药9天后递送率为12%。
注:在pH5和pH7.4条件下对其进行了递送试验。利用N2吸附和PXRD对药物的卸载谱进行了监测。
8. 小结与展望
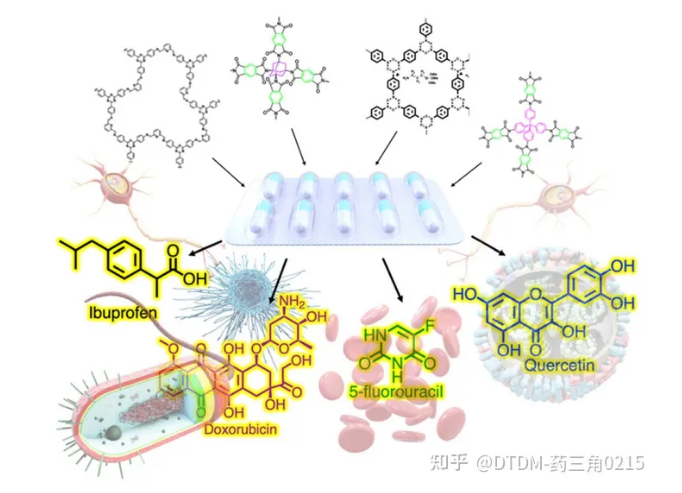
图.14 一些具有代表性的COF支架被用于向靶点递送多种药物
COFs是一种具有广泛功能的有机多孔材料,具有生物相容性、易于功能化、可调节的几何形状和开放的孔隙结构等优点。COFs已经在不同的研究领域得到了广泛的研究和应用,**终在推进领域和应用技术领域发挥了重要作用。COFs 系列多孔材料向我们展示了生态友好、兼容和环境危害小、并作为治疗几种疾病的药物传递载体的**新进展。它们在生物医学上的应用包括生物大分子固定化、药物包封/解封以及光动力和光热治疗。本文精确地讨论了药物分子(DOX, ibu,胰岛素等)的包封/解封(图14),并对细胞内递送特别给予关注。一系列文章的解读,目的是为了解药物包封/解封的现状,从而导致药物在生物介质中传递,如表1所示。除了COFs有趣的结构参数外,本文还强调了与递送过程相关的生物学过程。

表.1-1 COFs药物递送载体汇总
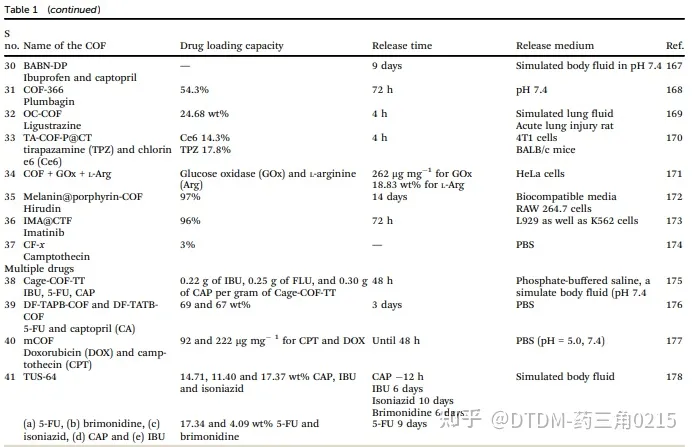
表.1-2 COFs药物递送载体汇总
通过讨论,我们了解到药物包封一般是在溶剂介质中进行,将COF与药物分子搅拌在一起进行包封,然后将载药的COF进行卸载。有时仅在溶剂中或在活细胞中监测脱胶囊。改变卸药介质的pH值会影响卸药效果。在TAPB-DMTP-COF的情况下,在pH为5或6.5时,大部分药物在前两个小时内被卸载,而在pH为7.4时,同样的情况为40%。DOX@COF的形态在2 h内由球形变为不规则块状,其连接发生断裂,这可能引发药物的卸载。在SS-COF的情况下,在pH为5的PBS中引入10 mM谷胱甘肽导致药物脱离胶囊。在COF@IR783@CAD的情况下,24小时后发现PBS中的卸载量为-48.2%。通过流式细胞术和共聚焦显微镜观察4T1细胞的细胞摄取情况。孵育96 h后, DiSe-Por的DOX脱囊率为27.9%,pH为7.4时降了42.4%。在pH 5.0时,TpASH在72 h内释放74%的药物。NOP-14@2 wt%时,IBU药物在B5 h内释放50%,而在72 h内释放全部药物。总之,我们知道降低pH值可以将药物从COF支架中释放出来。在少数情况下,释放发生在COFs的支架坍塌。我们注意到COFs在生物相容性、形态、稳定性、药物释放控制、生物降解性以及与不同药物类型的相容性等几个参数方面的生物医学用途的优势。探讨了几种COFs的生物相容性。在TpASH的情况下,使用乳腺癌细胞株(MDA-MB-231)进行MTT试验来探索其细胞毒性,该细胞株在COF存在下显示了细胞活力。另一个例子是NOP-14,其中MTT试验用于探测其低毒性。以非癌性人乳腺上皮细胞mcf10a为研究对象,探讨TTI-COF的生物相容性。另外,HAPTP-TPA即使在100 mg mL1的浓度下也表现出低毒性。OC-COF在WI26-VA4、A549、Calu-3细胞和SD大鼠中的生物相容性也得到了证实。与PI-COFs-2/3在200 mg mL-1浓度下孵育24 h后,裸COFs的存活率超过80%。综上所述,这些结果有助于建立COFs的生物相容性并支持其在该领域的进一步应用。
关于COFs的形貌,一个关键的问题是它们的粒度。如前所述,为了有效的细胞摄取,需要200纳米的尺寸。不同版本的PEGCCM@APTES-COF-1被发现是单分散的,尺寸分别为PEG350-CCM@APTES-COF-1的150 (±8)nm, PEG1000-CM@APTES-COF-1的170 (±7)nm和PEG2000-CCM@APTES-COF-1的230 (±10)nm。不同的聚乙二醇密度导致不同的形态。在Liu小组的另一个例子中,所得到的COF被发现是球形的,平均直径为30-40纳米。发现OC-COF具有立方形态,尺寸在 2-3mm范围内。另一个参数是COFs的表面积,其中TAPB-DMTPCOF显示的表面积为1000 m2 g-1。SSCOF的面积为672 m2 g-1,低于TCOF的58.871 m2 g-1。PI3-COF的BET表面积为1000 m2 g1, PI-2-COF的BET表面积为1700 m2 g-1。DiSe-Por 的表面积为73.5 m2 g-1,载药后减小到7.9 m2 g-1。COFs的表面积是药物装载的一个很好的指标/标记,一旦药物装载,COFs的表面积就会减少。
可降解性是使用COFs给药的重要性质,其中支架在药物释放前的降解是一个问题。或者,如果作为递送载体的COFs在药物递送后没有降解,这可能会导致生物环境中的副反应。例如,TAPBDMTP-COF在PBS介质中表现出希夫碱键的降解,从而导致药物传递。刘课题组报道了具有生物降解性的COFs的合成。当pH设置为6时,药物脱囊率高于pH 7.4,表明COF支架降解。在COF DiSe-Por中,受pH和GSH的影响内化后,支架的C=N和Se-Se键被劈开,**终帮助药物释放。OC-COF是可生物降解的,并在卸载药物后从体内消除,作为具有可生物降解性的COFs的一个完美例子。与其他COFs类似,同样的生物降解需要检查作为生物材料的适用性。
COFs的孔径大小是决定多用途药物负载的决定性因素。事实上,它们的腔体必须很大,才能容纳药物。例如,孔径-10 Å可能有助于布洛芬等药物的顺利装载。在PI-COF-4和PI-COF-5之间,后者的孔径较小,因此释放速率较低。PAF-6呈二维有序结构,孔径均匀,为11.8 Å。以TTA-DFP-nCOF为例,测得其孔径为1.7 nm,靶药胰岛素的分子大小为2.5-3 nm。因此,胰岛素被嵌入到COF层中,而不是内化在其毛孔中。
虽然研究人员在这一方向取得了显著进展。但是,COFs在体外和体内生物医学用途方面仍然表现出几个基本缺点,如下:
(a)它们在细胞内的内化模式尚不清楚。很明显,drug@COF加合物是内化的;然而,从文献报道来看,内化的途径并不明确。在这种情况下,通过共标记溶酶体、线粒体等进行明确的研究将有助于进一步追踪传递;
(b)一些关于COFs的文章报道了药物传递过程中的键裂解。因此,COF支架有可能坍塌成几个小的有机碎片或聚合物碎片,这可能在体内引起严重的毒性。因此,强烈建议在体外和体内研究COFs的降解;
(c)在未降解的情况下,有必要了解药物递送后COF支架的去向,以避免细胞/体内存在外来分子;
(d)报告的结果主要讨论了COFs的细胞毒性。然而,在将COFs作为体内应用的载体之前,对其毒性如神经毒性、血液相容性、遗传毒性、对生殖系统的影响以及致癌性水平等进行详细的研究是非常必要的;(e)药物装载通常在己烷、DCM或DMF介质中进行,这些介质对细胞有潜在毒性;相反,二甲基亚砜在生物上更加友好。
展望:
因此,在设计基于下一代COFs的未来探针时,可以优先考虑几个步骤:
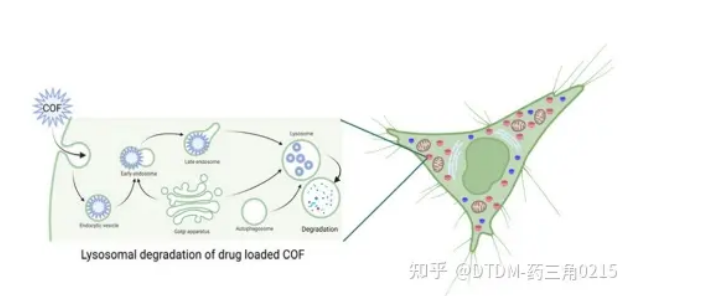
图.15 溶酶体腔室内载药COFs的降解,(溶酶体递送的一个可能缺点)
A)支架:探针多采用希夫碱连杆结构。C=N容易水解,特别是在酸性环境中。这些分子的细胞递送可能不会绕过溶酶体途径,因此在溶酶体的低pH下,支架的水解是可能的(图15和图16a) 123因此,溶酶体逃逸是必要的,这可以通过几种途径实现,其中一种想法是通过合成后修饰在COFs表面引入足够的正电荷.
(B)已知细胞表面带负电荷,因此drug@COF表面带正电荷将有助于内在化。然而,如果COF从一开始就带正电,那么在增压颗粒内的药物装载可能会有问题。因此,在这种情况下,合成后修饰是有帮助的,在药物装载后,可以在COF表面引入带正电的基团。同样,聚乙二醇(PEG)型功能分子作为溶解度标签可以在药物装载后引入,以获得更好的亲水性。在未来,类似的细胞穿透肽(CPP) 和细胞穿透COFs可以被计划/设计,然后在实验室中合成以增强细胞传递(图16b)。
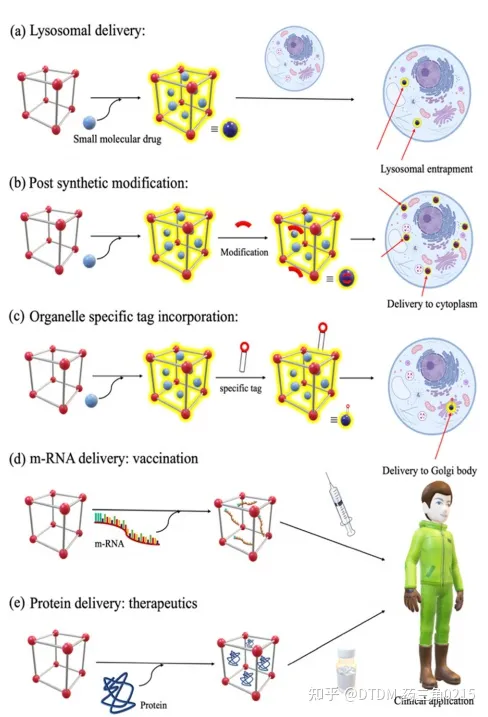
图.16 未来COFs递送概念
(C)考虑到递送后探针将有机会进行蛋白水解,从而有助于消化COFs,酰胺作为主链的效用将是有利的。此外,用酰胺代替希夫碱可以提高生物相容性。
(D)对于靶向递送,可以设计和合成细胞器特异性COFs,在药物装载后,它们的表面可以用细胞器特异性标签进行修饰。在这里,考虑没有膜破坏活性的细胞渗透性线粒体特异性肽是很有趣的用COFs连接标签将导致加合物完全由细胞微环境的极性直接指向线粒体。其他细胞器也有类似的标签,可以附着在COFs表面以制备细胞器特异性COFs(图16c)。
(E)通常,小分子药物是靶向递送的。众所周知,具有更好靶标选择性的蛋白质治疗方法目前正受到越来越多的关注;然而,由于它们的结构、溶解性或其他相关原因,它们可能难以递送另外,m-RNA递送作为疫苗递送的一部分同样非常重要。因此,作为下一代递送剂,蛋白质或m-RNA可以作为靶标(图16d和e)。
简而,在多孔材料家族中,COFs是**年轻的成员。到目前为止,重点是定制合成以及多功能表面改性,合成后改性等。在药物递送方面已经报道了一些新结果,这些结果确立了材料成为载体的能力。现在应该把重点放在给药领域,在这个领域我们需要知道COFs是如何影响生物参数的。我们认为,COFs的主要优点是其无金属支架以及易于功能化和可调的几何形状。我们预计,在可预见的未来,COFs将成为药物输送领域的潜在竞争者,导致其临床应用。




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询