**分子的羧基引入13C同位素标记,需要哪些反应步骤
把原料溶解在二甲基甲酰胺(DMF)中,然后放在13C标记的二氧化碳气氛(13CO2,1个大气压)里,等几个小时就搞定了!根据底物结构的不同,反应甚至在20 ℃下经过1小时就能以高收率获得高纯度的13C标记产物,甚至DMF溶液中有水也不要紧,只要别超过0.01 M就可以了。
通常的办法都包括:把原来的羧基脱除,再想办法用13C标记的碳源引入一个羧基。有机化学家在这两类反应上都做了大量的研究。尽管羧基在大多数条件下都相当稳定,但为了脱羧,前有入选有机化学教材的柯尔伯脱羧,后有近年来火热的光氧化还原脱羧。而要引入羧基,则常常需要依赖强亲核试剂或在电化学过程中原位形成等当量还原剂。反应条件上的巨大差异使得脱羧和羧化反应看似不可能在“一锅”里完成。
但是,在自然界,脱羧反应和羧化反应却一直是在“一锅”里完成的。原则上,如果脱除羧基形成二氧化碳能和它的逆反应同时发生,形成一个化学平衡,那么原则上只要在反应体系中加入过量的13C标记二氧化碳,就能推动化学平衡向生成13C标记羧基的方向移动。
实际上,近年来已经有一些小组探索了简单脂肪酸的可逆脱羧/羧化反应,但高温(280 ℃-400 ℃)限制了它们的应用价值。在室温或接近室温的条件下实现这个过程依然是挑战。
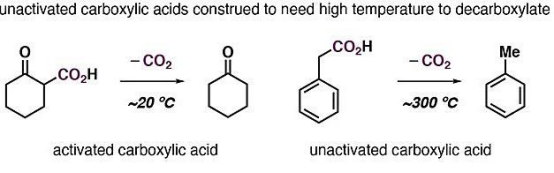
脂肪酸可逆脱羧/羧化反应的探索
在这项工作中,将4-氰基苯乙酸钾(1)溶解在DMF中(浓度0.1 M),通入13 mL的13C标记二氧化碳(1个大气压,按当量算约6倍当量,此时二氧化碳在DMF中的浓度约0.2 M)。通过监控反应,发现在20 ℃下,同位素交换反应在15小时左右达到平衡,简单的酸碱萃取即可以83%的收率获得13C富集的产物。
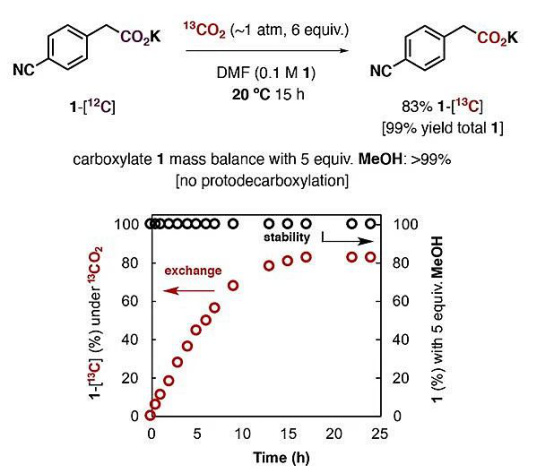
1的CO2交换(红色)和MeOH质子化(黑色)的比较。
进一步的研究发现,实验中羧酸盐的抗衡阳离子和溶剂种类对反应有着重要影响。如果仅是羧酸,即4-氰基苯乙酸,升温到70℃也没有明显反应;抗衡阳离子为锂离子和钠离子时虽然能反应,但速度较慢。介电常数大于30的极性非质子溶剂对反应是必要的,但体系中少量的水(低于0.01 M)以及甲醇也能被兼容。这些结果表明溶剂化的离子对能**促进反应进行。

反应条件研究。
在随后的底物拓展研究中,研究人员发现,一系列包含相邻芳基、羰基、氰基或磺酰基的羧酸盐分子都可发生可逆的脱羧/羧化反应。标记产物的比例很大程度上取决于13CO2过量的程度(化学平衡)。实验表明,产物中13C标记的比例可高达95%(13CO2 ~ 50 equivalents)。高转化率,加上操作的简便性,这是非常有竞争力的一种获得13C标记羧酸的策略。简便的操作也让反应能够兼容更多的基团,包括硼酸、各种卤原子、醛、酮、酯、酰胺、磺酰基以及一些有反应活性的芳杂环。对众多官能团的兼容性使得这一方法可以直接用于获得多种13C标记的**分子以及氨基酸等重要的活性有机分子(下图)。
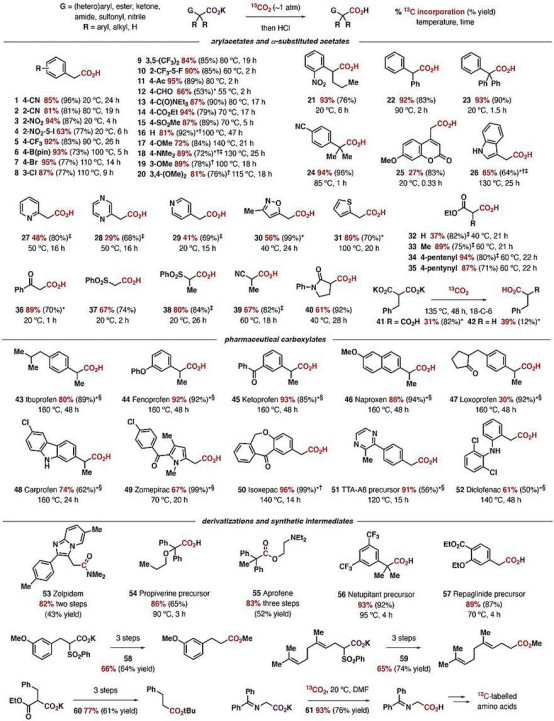
底物拓展及应用。
同位素标记技术的底物拓展中反应达到平衡所需的时间以及转化率(先终标记产物的占比)与底物稳定阴离子的能力相关而与氧化还原能力关系不大,因此,他们猜测反应应该是通过直接脱羧或者形成烯醇式的过程实现的。这看似与反应对醛酮等官能团的兼容性相矛盾,但其实需要注意到,在体系中二氧化碳的浓度是相当高的(0.2 M),因此能优先与脱羧后形成的碳负离子反应。
实际上,在氮气气氛和弱布朗斯特酸存在条件下,确实会出现脱羧质子化,并且速率与布朗斯特酸的酸性成反比,表明布朗斯特酸捕获脱羧中形成的二氧化碳是决速步骤。在氮气气氛下,实验中还观察到原料发生“歧化”反应,从表观上看,一个原料分子的羧基与另一个原料分子上的α-H发生了交换。这表明,在实验条件下,碳负离子确实有很强的捕获二氧化碳的能力。但这种过程似乎是不可逆的。研究人员还注意到,在实验条件下,α-H的H/D交换速率也得到**提升,可能的原因是形成了酸酐中间体,提升了α-H的酸性。
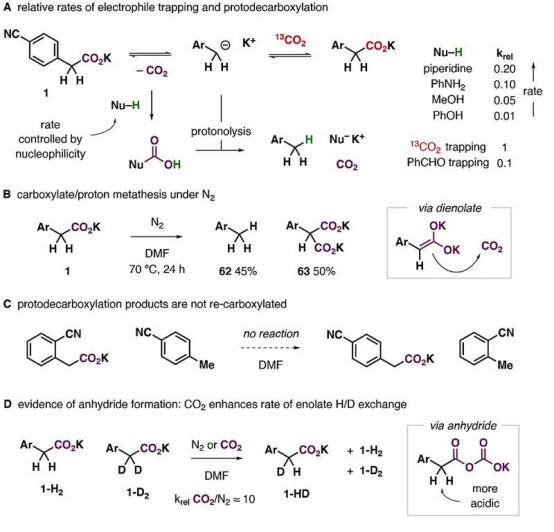
机理研究。
上述机理研究启发研究人员利用这种温和的脱羧反应生成的亲核试剂和醛、酮等进行反应(氮气气氛下),通过形成C-C键构建一系列分子。
来源:本文来源网络,版权归相关权利人所有,如侵权,请联系删除




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询