外泌体对细胞和动物模型的影响
室实验仅能证明上下两室的两种细胞之间确实发生了物质运输传递,接下来,通过外泌体跟踪测试这些ATM分泌的外泌体是否可以被脂肪细胞吸收。从ATM细胞提取外泌体,加上PKH26标签,添加到3T3-L1脂肪细胞培养基中,12h后,在细胞里面观察得到红色的带PKH26标签的外泌体。
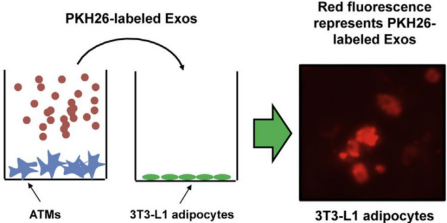
外泌体对细胞和动物模型的影响
已经证实ATM细胞分泌的外泌体能够转运miRNA到3T3-L1脂肪细胞,接下来可以把外泌体添加到细胞培养基或静脉注射到动物模型,观察表型。从肥胖小鼠ATM中提取外泌体,静脉注射到正常小鼠中,2周后,发现小鼠的葡萄糖耐受能力、胰岛素敏感性、葡萄糖输注率(GIR)、胰岛素刺激的葡萄糖代谢速率(IS-GDR)、肝脏糖产出量(HGP)和循环系统中的游离脂肪酸(FFA)都下降了,而瘦的小鼠来源的ATM-exo没有产生影响。表明肥胖动物的ATM细胞产生含miRNA的外泌体,在体内减弱胰岛素敏感性(图1)。将上述外泌体添加到多种细胞株的培养基中,24h后可观察得细胞胰岛素敏感性下降,与动物实验结果一致(图2)。
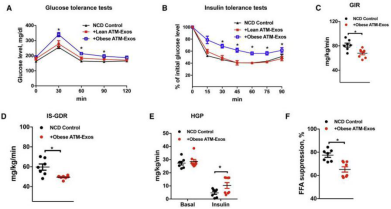
图一
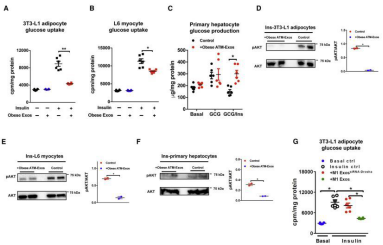
图二
外泌体miRNA测序
已知是外泌体中的miRNA发挥了**的作用,可到底是哪些miRNA呢,可以通过高通量测序寻找其中起着关键作用的分子。测序样本:瘦的ATM-exo VS 肥胖ATM-exo。测序获得的差异表达miRNA中,miR-155曾被报道通过**PPARγ,影响脂肪细胞分化,miR-155继续研究
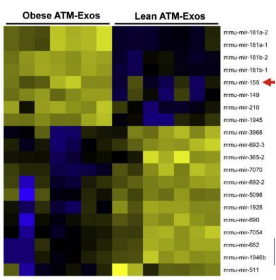
图三
miRNA的功能
3T3-L1脂肪细胞转染miR-155 mimic后,细胞葡萄糖吸收量减少(图4);敲除miR-155后细胞胰岛素刺激的葡萄量吸收量上升;但移植骨髓后,miR-155重新表达,使细胞的葡萄糖吸收再次减少(图5)。
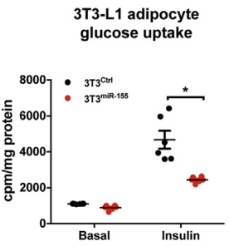
图四
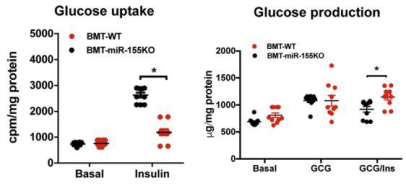
图五
(1)脂肪组织巨噬细胞分泌的外泌体miRNA可调节体内和体外胰岛素敏感性;
(2)脂肪组织巨噬细胞分泌的外泌体向胰岛素靶细胞传递miRNA;
(3)肥胖ATM外泌体**瘦小鼠引起胰岛素抵抗;
(4)瘦素ATM外泌体**肥胖小鼠改善胰岛素抵抗;
(5)肥胖ATM外泌体含有miR155,可引起胰岛素抵抗。
来源:本文来源网络,版权归相关权利人所有,如侵权,请联系删除。




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询