外泌体介导的CRISPR-Cas9递送
在CRISPR序列的指导下,Cas9酶可以在细胞中以前所未有的精度、效率和灵活性编辑基因组DNA。但是,离体设计的CRSPR-Cas9系统需要递送到目标细胞和生物中进行基因**。CRISPR-Cas9系统的传递可通过物理相互作用、化学修饰和生物载体实现。CRISPR-Cas9系统可通过脂质双分子层中的短暂间隙被输送到细胞中,该间隙由物理方法引起,例如电穿孔、流体动力注射、膜变形等。尽管简单易行,但可能对细胞膜造成不可逆的生理损伤。CAS9-sgRNA的化学修饰还将使它能够传递到细胞,或者诸如噬菌体、病毒和细胞外囊泡等生物载体可以介导CRISPR-Cas系统向细胞的传递。
外泌体作为CRISPR-Cas9质粒的载体
与病毒载体相比,来自某些细胞来源的外泌体可以选择性地将货物递送至**组织。Kim等报道称**细胞来源的外泌体可以将CRISPR-Cas9系统转运至靶**。
用于CRISPR-Cas9递送的工程外泌体
天然外泌体并非设计来传递大分子,例如质粒。因此,外泌体中质粒的负荷低。然后需要对外泌体进行工程改造,以提高质粒的效率和容量。工程外泌体还赋予了这些转运纳米颗粒以靶向能力,可将货物转运至特定细胞或组织。在外泌体表面表达的标志蛋白CD63和CD9通常被选作外泌体工程的靶蛋白。
外泌体-脂质体杂交体,用于基因传递
外泌体的纳米级尺寸(40–160 nm)使其成为小型**剂(例如化合物、siRNA和miRNA)的合格载体。对于大分子,例如小大小为5–6 kb的CRISPR-Cas9表达质粒,天然外泌体的容量仍然相对较低。另一方面,脂质体能够包封和传递大质粒,但由于脂质的非天然性质,具有较高的细胞毒性。外泌体膜的脂质双层与脂质体的融合形成了外泌体-脂质体杂合体,从而可以包裹和递送大型DNA分子,例如CRISPR-Cas9表达质粒,还减轻了脂质体的毒性问题(图1)。因此,外泌体-脂质体的杂交扩大了外泌体在**输送中的应用范围。
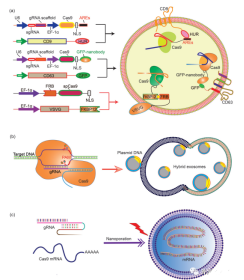
将大核酸封装在外泌体或外泌体来源的囊泡中
产品供应:
上述产品与相关检测服务均可提供,仅用于科研!
wyf 01.15




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询