外泌体与靶向载体技术
外泌体作为靶向载体的优势
外泌体和脂质体与纳米材料载体相比有很多优势,例如:低免疫原性,来源于DC的外泌体含有主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类和Ⅱ类分子[23],因此不会被免疫细胞清除;半衰期长,外泌体表面高表达CD47蛋白,CD47蛋白是一种广泛表达的整联蛋白相关跨膜蛋白,是信号调节蛋白α(signal regulatory protein α,SIRPα)的配体,CD47-SIRPα结合引发“不要吃我”**吞噬作用的信号,可以防止外泌体被单核细胞或巨噬细胞吞噬,增加外泌体在体内的半衰期;外泌体还具有穿透血脑屏障、胎盘屏障的能力;外泌体可以与传统的病毒载体结合使用,形成一种功能更强的基因**工具,如Orefice等利用外泌体包裹腺相关病毒(adeno-associated virus,AAV)载体来靶向**神经退行性疾病,动物实验获得了良好的效果,为脑部疾病的**带来了希望。外泌体载体的以上优势吸引了越来越多的研究者去研究外泌体载体,拓展了外泌体载体的应用范围。
外泌体作为靶向**载体的基础
外泌体在细胞间的通讯交流中扮演着重要角色,在人体中,外泌体携带着蛋白、核酸和脂质等大量生命信息,需要遵循人体运行的有序性,否则必然会导致人体信息传递的错乱,破坏人体功能的平衡,所以有理由相信外泌体在体内是靶向运输的,这为开发外泌体的靶向改造提供了可能性。通过改造产生外泌体的母细胞,使其分泌的外泌体膜表面产生靶向目标细胞的蛋白,从而使外泌体产生所需的靶向性,证明可以对外泌体进行靶向性改造。之后越来越多的研究涌向外泌体的靶向**领域。
外泌体的靶向性改造技术
外泌体的产生受亲本基因的控制,通过基因工程手段导入融合归巢蛋白和外泌体的转膜蛋白的基因到亲本细胞中,使得想要的蛋白展示在外泌体膜表面。对外泌体进行靶向改造的过程就是膜蛋白展示的过程。目前已经验证的转膜蛋白和归巢蛋白的组合见表1
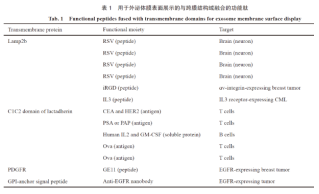
归巢蛋白与在外泌体膜表面已知富集的跨膜蛋白融合,从而展示在外泌体膜表面。对于利用乳凝集素C1C2结构域作为锚定点的组合,因为凝集素是膜相关蛋白,而不是跨膜蛋白,所以使用凝集素C1C2结构域作为外泌体膜表面的锚点没有利用外泌体的转膜蛋白可信。以下简要介绍溶酶体相关膜蛋白2(lysosomal-associated membrane protein,Lamp2)和血小板衍生的生长因子受体(platelet-derived growth factor receptor,PDGFR)的研究。
利用未成熟的DC作为工程化外泌体的来源,通过将狂犬病毒糖蛋白(rabies viral glycoprotein,RVG)基因和一种在外泌体膜表面富集的Lamp2b基因融合,然后利用载体转染未成熟的DC,获得表面表达融合蛋白的外泌体,靶向神经系统中的乙酰胆碱受体,将RVG和Lamp2b的基因融合克隆到载体上并转染未成熟的DC,被展示在外泌体表面的Lamp2b-RVG蛋白将会靶向神经细胞。提纯之后的外泌体利用电穿孔的方法装载 GAPDH-siRNA,静脉注射结果发现小鼠脑中的神经元、小胶质细胞和少突胶质细胞中的GAPDH基因被敲除,预暴露于RVG-外泌体并没有导致敲除削弱,除脑以外的其他组织中并未发现非特异性的敲除。使用外泌体装载siRNA靶向**阿尔茨海默病在小鼠实验中获得了较好的结果,与野生型小鼠相比较,靶向**组的小鼠体内的β分泌酶1(β-secretase 1,BACE1)的60%水平的mRNA和62%水平的蛋白质被敲除。证明外泌体不仅可以获得性地形成靶向性而且可以穿透血脑屏障,已在**阿尔茨海默病方面显示出巨大潜力。
利用HEK-293细胞作为外泌体的来源,利用特殊的pDisplay载体携带靶向基因转染HEK-293细胞。利用表皮生长因子(epidermal growth factor,EGF)和GE11多肽靶向EGFR高表达的****细胞,利用脂质体转染的方法使外泌体加载siRNA(let-7a miRNA)。pDisplay载体中含有PDGFR跨膜区域,将会促进蛋白质在质膜上的表达。融合基因中设置血细胞凝集素(hemagglutinin,HA)抗体基因标签,以便于后续的检测和筛选。GE11是通过噬菌体展示技术筛选出的一种含有11个氨基酸残基的多肽,能**地靶向结合于细胞膜表面的EGFR受体。该实验靶向性获得的策略延续了上述研究,但是该研究利用电穿孔法并不能成功的装载siRNA到外泌体,认为可能是由于细胞类型不同,分泌的外泌体也有差异。
通过转膜蛋白和归巢蛋白相融合的策略能将多肽展示在外泌体膜表面,但是也会有一些问题,例如,展示在外泌体膜表面的归巢肽有时会被细胞内或体液中的蛋白酶降解从而失去其靶向性,在有靶向性的多肽的N端,利用工程手段加入一个糖基化多肽序列GNSTM可以保护靶向多肽免遭蛋白酶降解,增加在细胞和外泌体中的表达,增强外泌体对靶细胞的靶向能力。另一方面,如果归巢肽相对分子质量太大,当其和膜蛋白融合的时候,会干扰融合蛋白的表达或正确折叠,因此寻找受体的核心短片段,尽量减少归巢肽的相对分子质量对于解决外泌体作为靶向**载体的靶向性难题具有重要意义。
来源:本文部分材料来源网络,版权归相关权利人所有,如侵权,请联系删除!
WYF 01.19




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询