白介素10(IL-10)是一种功能强大的免疫调节剂,具有强大的和组织再生能力。在AKI中,研究表明IL-10可以通过限制炎症细胞因子的产生和免疫细胞浸润来预防缺血,顺铂或输尿管梗阻引起的肾损伤,这表明IL-10可能成为AKI的新型疗法。
我们发现胞外囊泡作为强大的纳米载体进行**输送在化学、基因等领域展现出巨大的应用前景。与现有的递送系统相比,细胞外囊泡的独特优势是其来源,这使其能够逃避吞噬作用,延长**循环半衰期并降低免疫原性。因此,基于EV的**递送系统可能是推动IL-10用于AKI的新型给药策略。
因此,我们研究了一种从巨噬细胞衍生的负载IL-10的细胞外囊泡(IL-10+EV)的制备方法,并研究了IL-10+细胞外囊泡在缺血性AKI鼠模型中的效果。IL-10+EV能够增强IL-10的稳定性,并地靶向损伤的肾脏,这是由于其表面富含粘附成分包括整联蛋白α4β1,α5β1,αLβ2和αMβ2。IL-10+EV的不仅可靶向肾小管间质中的巨噬细胞,而且可靶向肾中的肾小管上皮细胞(TECs),可****肾脏缺血/再灌注(I/R)损伤,并防止AKI向CKD的转变。具体而言,文章显示IL-10 + EV了哺乳动物雷帕霉素(mTOR)的靶标,因此促进了线粒体代谢以维持TEC中的线粒体稳态。同时,IL-10 + EV还可诱导巨噬细胞向M2型转化,促进肾脏。这个发现强烈支持将细胞外囊泡用作IL-10的多功能递送系统,将其作为缺血性AKI的策略。
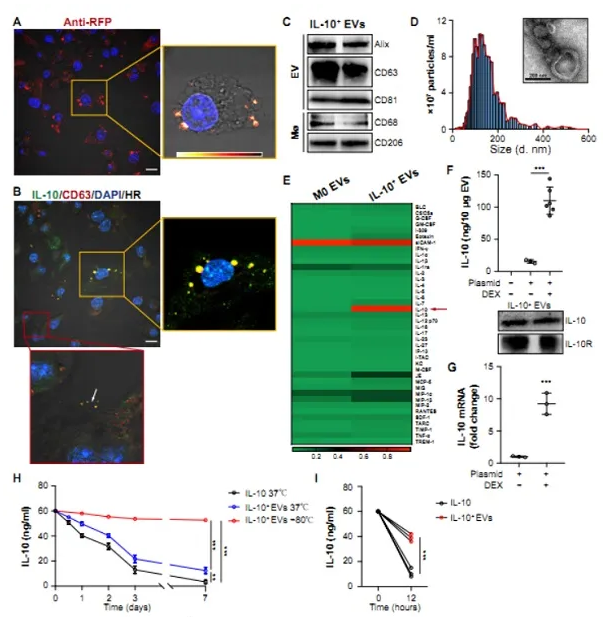
A)用RFP标记的IL-10转染RAW细胞,然后用地塞米松刺激
(B)在工程RAW细胞中对IL-10(绿色)和EV标记CD63(红色)进行免疫染色
(C)在IL-10+细胞外囊泡中对EV相关的(Alix,CD63和CD81)和巨噬细胞相关的标志物(CD68和CD206)进行蛋白质印迹分析
(D)IL-10+细胞外囊泡的尺寸分布和代表性TEM图像
(E)显示从抗体阵列分析获得的每种细胞因子的蛋白质水平
(F)细胞外囊泡中IL-10的ELISA分析,以及IL-10+细胞外囊泡中的IL-10和IL-10受体的蛋白质印迹分析(n = 3或6)
(G)通过实时定量PCR测量IL-10+细胞外囊泡中的IL-10 mRNA
(H-1)比较IL-10 +细胞外囊泡和游离IL-10在不同条件下的稳定性,包括在37°C或-80°C下放置一周,在pH 5.5溶液中12小时
图2.肾靶向IL-10+EV
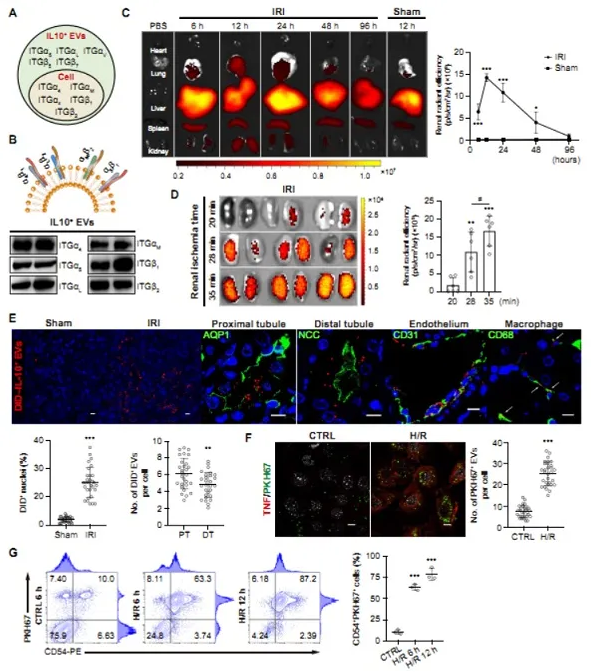
(A)以亲代RAW细胞为对照的IL-10+EVs蛋白质组成的LC-MS/MS分析
(B)蛋白质印迹分析
(C-E)为了分析体内分布,给小鼠静脉注射DID标记的IL-10+EV(n=3)
(C)注射后6、12、24、48和96小时(缺血时间35分钟)对指定器官的荧光强度成像
(D)缺血20分钟,28分钟和35分钟的IRI肾脏在12小时时的荧光强度成像
(E)代表性共聚焦图像显示DID标记的IL-10+EV在小管(包括近端小管和远端小管),内皮细胞(CD31)和巨噬细胞(CD68)中的蓄积
(F-G)H/R诱导的TECs摄取PKH67标记的IL-10+EV(n = 3)
图3.IL-10+EV可预防小鼠的肾脏I/R损伤
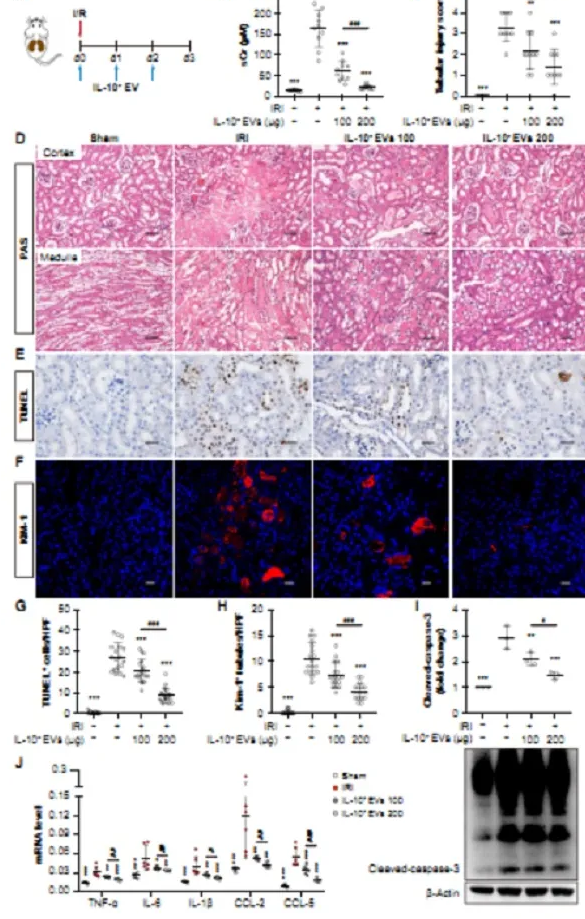
(A)实验设计示意图
(B)IL-10+EV对血清肌酐的影响(n = 10)
(C)基于H&E染色的肾小管损伤的量化(n = 10)
(D)肾皮质和髓质的H&E染色的代表性图像
(E-G)TUNEL染色和凋亡细胞定量的代表性图像(n = 6)
(F-H)代表性共聚焦图像和KIM-1+小管的定量(n = 6)
(I)肾脏组织中caspase-3的蛋白质印迹分析(n = 3)
(J)实时定量PCR分析肾脏组织中炎性细胞因子mRNA水平(n = 6)
图4.IL-10+EVs引起肾巨噬细胞表型转变
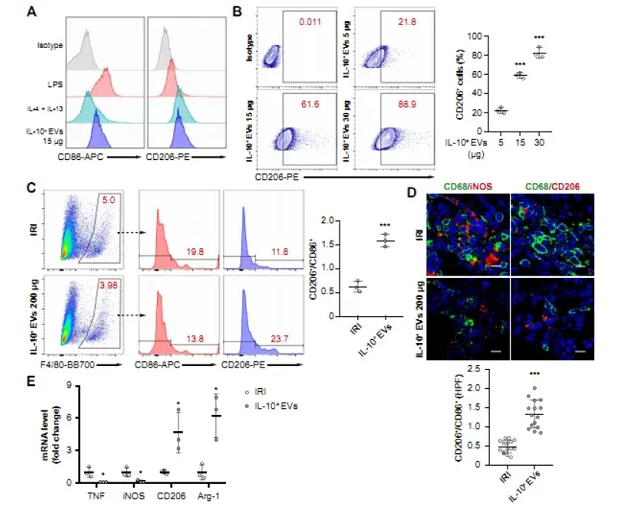
(AB)分别用LPS,IL-4+IL-13或不同剂量的IL-10+EV刺激BMDM 48小时( n = 3)
(C-E)IRI组与IL-10+EV组之间肾巨噬细胞表型变化的探讨
图6.IL-10+EVAKI-CKD转变
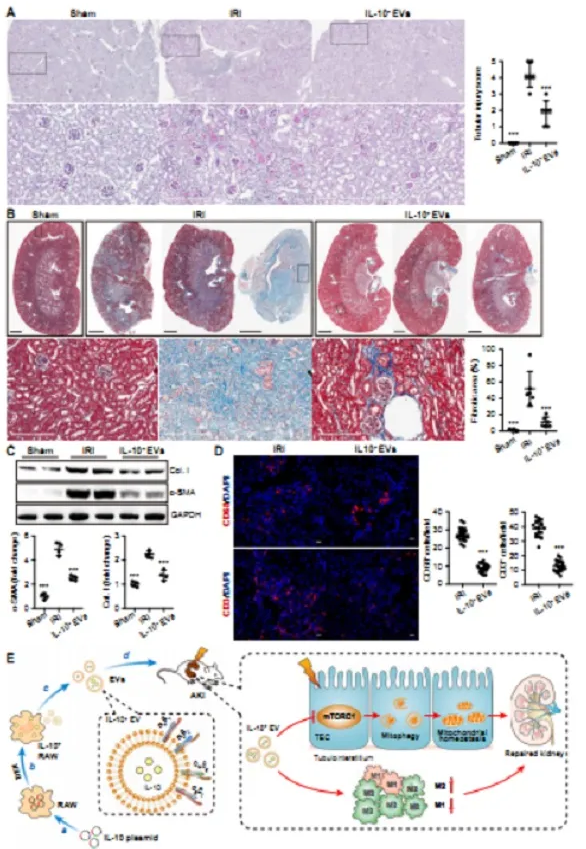
(A)PAS染色的代表性图像(n = 6)
(B)矢状面Masson三色染色的代表性图像(n = 6)
(C)肾组织中胶原蛋白I和α-平滑肌肌动蛋白(β-SMA)的蛋白质印迹分析(n = 4)
(D)肾脏切片中CD68+巨噬细胞和CD3+T细胞的代表性共聚焦图像(n = 6)
(E)用于缺血性AKI的IL-10+EV制剂的示意图




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询