外泌体是40-180 nm大小的细胞外囊泡,由各种类型的细胞广泛分泌,包括细胞,免疫细胞,干细胞和内皮细胞等。它们在长距离和短距离的细胞间通信中起着至关重要的作用。有研究在来源的外泌体膜中发现了各种特定的表面粘附分子,它们介导了对同源细胞的靶向,同时外泌体膜上高表达的CD47蛋白可以帮助外泌体逃脱巨噬细胞的吞噬作用。据我们所知,此前还没有外泌体膜包被仿生纳米颗粒靶向清除CTCs并转移的报道。外泌体膜修饰的策略可以帮助纳米粒子规避巨噬细胞的吞噬作用,并靶向原发,识别CTCs。
外泌体膜包载仿生前药纳米系统的制备与表征
通过单硫醚键将亚油酸与PTX偶联来制备ROS敏感的PTX前药(图1)。使用乳液溶剂蒸发法将PTX-S-LA和CuB共装载到PEG-PCL纳米粒子中,以制备PCNP,其中P表示PTX-S-LA,C表示CuB。然后将PCNP与EM孵育以获取EMPC。相同的处理方法制备分别装载有PTX-S-LA或CuB的EMP或EMC。下图2显示了PCNP的流体动力学直径和形态,它们具有规则的球形形状,平均大小接近80 nm。PTX-S-LA和CuB在PEG-PCL纳米颗粒中的载药量分别为9 wt%和5 wt%,包封率分别为87.6%和69.2%。
使用梯度离心法提取外泌体。通过透射电子显微镜(TEM)成像探究外泌体的碟状结构,以及针对特征性外泌体标记物TSG101,CD9和CD81的蛋白质印迹分析,表明外泌体已成功分离。EMPC是通过对提取的外泌体进行低渗处理来制备的。将PEG-PCL纳米颗粒与EM进一步孵育以制备EMPC。通过降低的zeta电位,增加的粒径(〜100 nm)和TEM图像证明PEG-PCL纳米颗粒表面上EM的成功包被。
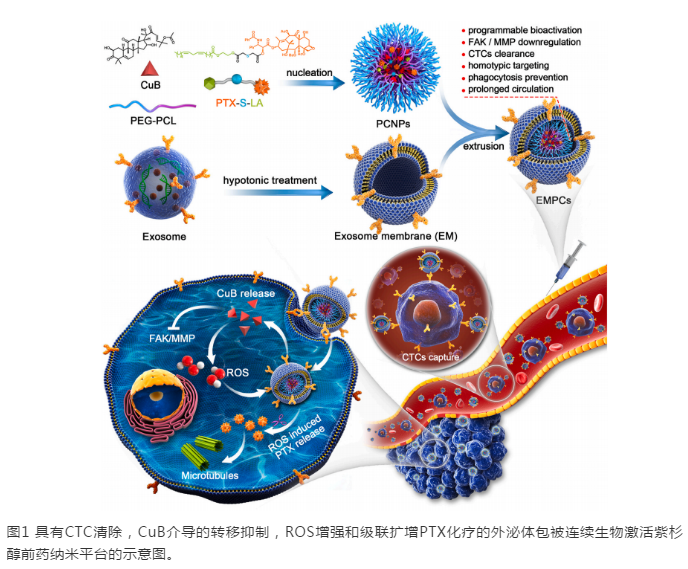
为了检查仿生外泌体纳米颗粒壳上膜蛋白的存在,按以前的报道进行了十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)和蛋白质印迹试验。膜蛋白标记的SDS-PAGE蛋白检查表明,在仿生外泌体纳米颗粒的蛋白质谱中,保留了从EM继承的独特蛋白。CD44和CD47对于转移至关重要。CD44是MDA-MB-231细胞上的表面粘附分子,在CTC与转移灶的粘附中起关键作用。CD47可以保护细胞免受巨噬细胞的吞噬作用,吞噬作用与的侵袭有关。如图2D所示,它们共存于**细胞膜和EM上,并在EMPC中保存良好,以介导同型**细胞靶向。
然后,用DiI(红色)标记EM,并用香豆素6(C-6,绿色)标记疏水核心,以检查EM完全覆盖PEG-PCL纳米颗粒。将双标记的纳米颗粒添加到MDA-MB-231细胞中2 h,并用共聚焦激光扫描显微镜(CLSM)观察。如图2E所示,DiI的荧光与C-6的荧光共定位,表明外泌体仿生纳米颗粒在细胞摄取一段时间后可以保留结构完整性。
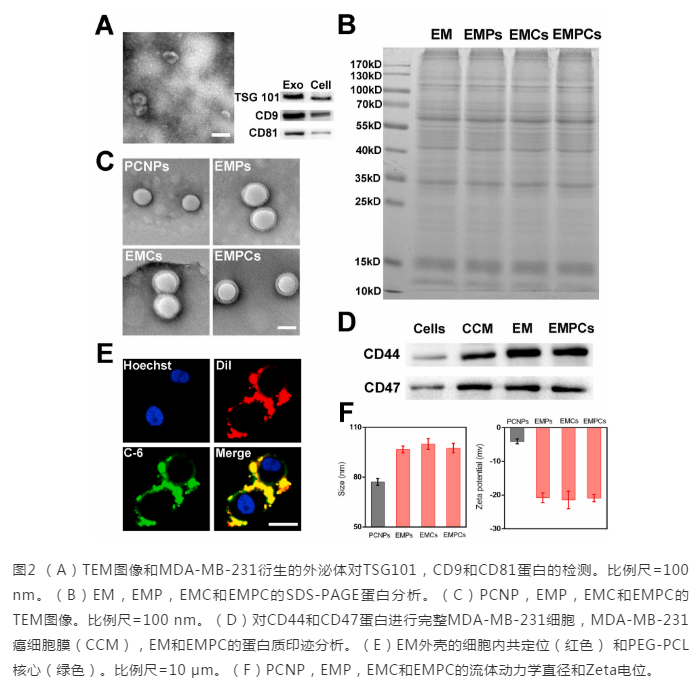
接下来,我们研究了C-6标记的PEG-PCL纳米颗粒(C-6 NPs),C-6标记的红细胞膜包被的PEG-PCL纳米颗粒(RM @ C-6 NPs)和C-6标记的在MDA-MB-231,MCF-7和NIH 3T3细胞中包被外泌体的纳米颗粒(EM @ C-6 NPs),以确认外泌体仿生纳米颗粒的同型**细胞靶向能力。进行了红细胞膜对PEG-PCL纳米粒子的修饰,以验证EM上的蛋白质在促进MDA-MB-231细胞内在化方面的关键作用。如图3A所示,C-6 NPs和RM @ C-6 NPs的C-6荧光比EM @ C-6 NPs的荧光低,这表明细胞摄取的提高归因于外泌体上的蛋白质。同时,将MCF-7和NIH 3T3细胞设为阴性对照,这进一步说明,用EM修饰纳米颗粒可特别增强同一来源**细胞的内在化。然后用流式细胞仪检测靶向作用的定量。如图3B所示,在MDA-MB-231细胞中,EM @ C-6 NP的荧光信号比C-6 NP和RM @ C-6 NP的荧光信号高3.5倍。相比之下,与C-6 NP和RM @ C-6 NP相比,EM @ C-6 NP在MCF-7和3T3细胞中未显示荧光增强。以上提到的所有结果表明,仿生外泌体纳米颗粒对同型**细胞具有选择性亲和力。
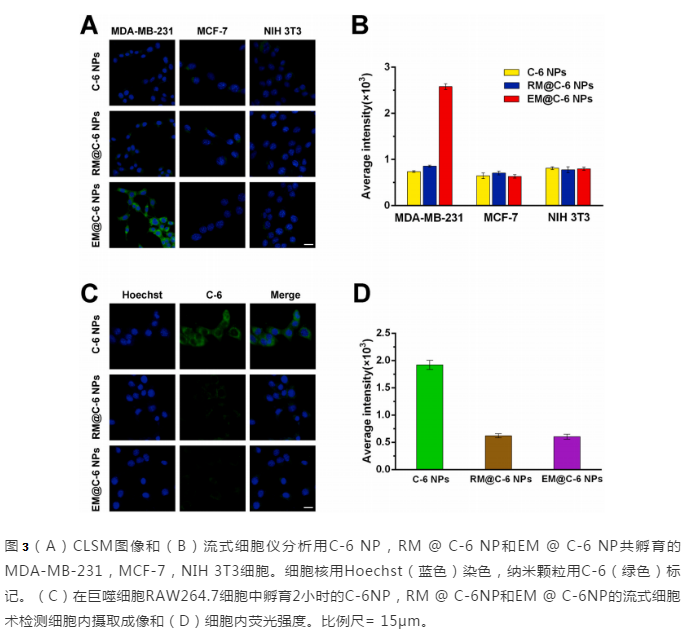 然后,验证了外泌体上的CD47对巨噬细胞吞噬能力的作用。将接种于12孔板的小鼠巨噬细胞RAW264.7细胞与C-6 NP,RM @ C-6 NP和EM @ C-6 NP孵育。如图4C所示,RM @ C-6 NP和EM @ C-6 NPs表现出比C-6 NPs低得多的内在化。对于流式细胞仪定量分析,与RM @ C-6 NP和EM @ C-6 NP相比,C-6 NP的荧光强度增加了3.1倍。结果证实,RM和EM上的CD47均可巨噬细胞的吞噬作用。
然后,验证了外泌体上的CD47对巨噬细胞吞噬能力的作用。将接种于12孔板的小鼠巨噬细胞RAW264.7细胞与C-6 NP,RM @ C-6 NP和EM @ C-6 NP孵育。如图4C所示,RM @ C-6 NP和EM @ C-6 NPs表现出比C-6 NPs低得多的内在化。对于流式细胞仪定量分析,与RM @ C-6 NP和EM @ C-6 NP相比,C-6 NP的荧光强度增加了3.1倍。结果证实,RM和EM上的CD47均可巨噬细胞的吞噬作用。
结论:
将ROS敏感的单硫醚键连接的紫杉醇-亚油酸前药(PTX-S-LA)和葫芦素B共同封装到PEG-PCL聚合物中制得双载药胶束,并进一步用细胞衍生的外泌体膜修饰,制备外泌体样序贯活化仿生前药纳米平台。该制剂不仅地靶向原发,而且特异性捕获清除CTCs,从而**了转移。细胞摄取后,纳米粒将**释放出葫芦素B,从而通过FAK / MMP信号通路调节**阻断**细胞的粘附,迁移和侵袭并转移。同时,释放的葫芦素B增加了细胞中的ROS水平,级联促进了PTX-S-LA前药的活化,起到一石二鸟的作用。该制剂表现出了出色的CTCs靶向能力、增强的前药活化、延长的体内循环时间、更多的蓄积和更深的瘤内渗透,在原位和异位MDA-MB-231模型中均表现出出色的原发性和抗转移活性。




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询