环糊精是一类环状寡糖,可以在内部疏水腔中容纳疏水小分子并形成包合物,进一步自组装成纳米颗粒,依据主客体分子的亲和力,通过改变条件实现客体分子的转换。
为进一步提升他汀类药物的药物功效,我们在本文中同时利用环糊精和他汀类药物的抗动脉粥样硬化作用,报道了一种基于环糊精-他汀类药物自组装的核-壳结构复合**,其核由甲基-β-环糊精(环糊精)和辛伐他汀(statins)的包合物组成,壳层由磷脂组成(图1)。该设计基于主客体的亲和力驱动,环糊精内部的药物可与胆固醇进行交换,以实现利用富含胆固醇的微环境进行靶向药物输送并清除胆固醇。该纳米粒子(CSNP)的两种药物组分的协同药物作用可以增强针对斑块的药物递送作用。
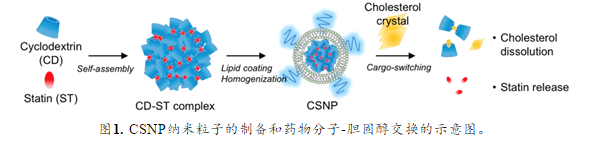
药物对CSNP纳米粒子的制备进行优化筛选。当环糊精与他汀或胆固醇混合时,在水溶液中形成环糊精-他汀或环糊精-胆固醇复合物,并且它们的水合粒径随着环糊精与他汀或胆固醇的摩尔比的增加而减小。在所有后续实验中,作者采用环糊精与他汀或胆固醇的摩尔比为6:1,此条件下可形成亚微米级大小的复合物,并可以通过尺寸排阻柱洗脱,纯化分离未结合的原料。随后,作者通过竞争性结合实验证明:相比环糊精-他汀,胆固醇和环糊精的结合更加紧密。将环糊精-他汀复合物,与胆固醇充分孵育,可观察到体系包封药物由他汀转换为胆固醇的过程。
随后,将环糊精-他汀复合物制成脂质体制剂,使其成为稳定的纳米粒子,以期延长血液循环,并能地递送至靶组织。为了优化这一脂质体涂层,使其更快速地实现膜内环糊精-他汀复合物和膜外胆固醇的分子交换,作者采用了DOPC(相变温度为-16.5℃)和HSPC(相变温度为52.5℃)两种磷脂分子建立脂质体模型。结果表明,在37℃下,DOPC脂质体中的环糊精对胆固醇晶体(CC)有着更为**的溶解作用。这表明CC可以破坏37℃下的DOPC的脂质体膜的液晶结构,即脂质体膜的存在可以允许内外部进行分子交换反应。这一部分实验**采用由DOPC和DSPE-PEG以摩尔比为95:5组成的脂质双层来包覆环糊精-他汀复合物,通过纳米多孔(100 nm)膜挤出进行均质化,得到CSNP纳米颗粒制剂。
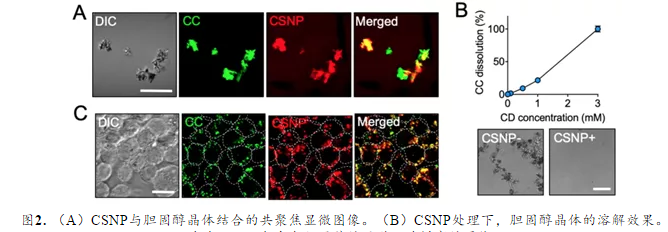
接下来,作者研究了CSNP是否可以在体外结合并溶解胆固醇晶体。共聚焦显微镜观察显示CSNP在37℃下5分钟内与CC相互作用。在37℃处理后24小时,6.5 mg CSNP可以溶解约0.2 mg胆固醇晶体。进一步,作者验证了CSNP可以进入巨噬细胞并溶解细胞内胆固醇晶体(图2)。此外,CSNP可通过释放的他汀类药物地降低活化巨噬细胞的促炎状态,环糊精成分可胆固醇介导的炎性体活化。
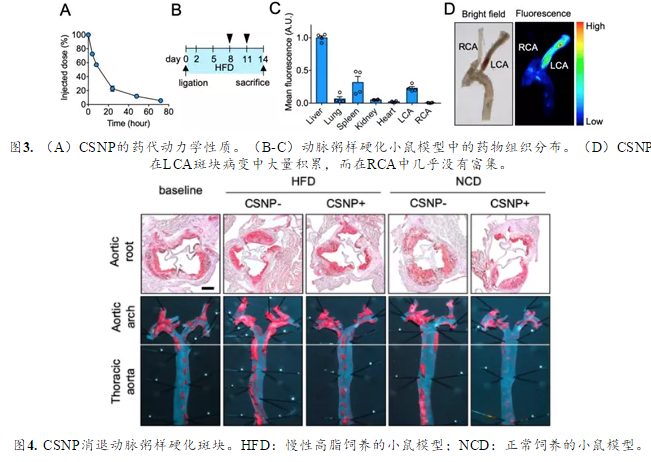
体内实验表明,CSNP的半衰期达到9 h,高于小分子环糊精(39 min)。作者使用了左颈动脉结扎的ApoE-/-小鼠的模型,(小鼠左颈动脉(LCA)中形成动脉粥样硬化),尾静脉注射后发现,CSNP可以通过破坏动脉粥样硬化斑块的内皮细胞进行被动靶向,从而地靶向动脉粥样硬化斑块,并降低胆固醇和巨噬细胞的斑块含量,从而协同地预防动脉粥样硬化和使已建立的斑块消退。(图3-4)。
β-环糊精/Fe3O4/氧化石墨烯(β-CD/Fe3O4/GO)磁性纳米复合材料
巯基β-环糊精修饰的磁性Fe3O4@SiO2/Au(Fe3O4@SiO2/Au/β-CD)复合材料
β-环糊精(β-CD)功能化离子印迹复合材料IIP-g-C3N4/β-CD
β-环糊精聚合物/石墨烯气凝胶(Pβ-CD/GAs)复合材料
二硫桥联β-环糊精-石墨烯(SS-β-CD-Gra)复合材料
壳聚糖(CS),2,6-二甲基-β-环糊精(DM-β-CD)
温馨提示:西安齐岳生物科技有限公司供应的产品仅用于科研,不能用于其他用途,axc,2020.03.03




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询