慢病毒CRISPR-Cas9技术获得HIEs基因敲除系
CRISPR-Cas系统,是原核生物的一种获得性免疫系统,用于抵抗存在于噬菌体或质粒的外源遗传元件的入侵。是存在于大多数细菌与所有古菌中的一种防御机制,以消灭外来的质粒或者噬菌体的DNA,
人类肠道组织源性类肠(HIEs)是建立的一种模仿人类胃肠道上皮细胞的体外培养模型,来源于肠干细胞,具有自我更新和干细胞多能性的能力。此外,HIEs也是首个人诺如病毒(HuNoV)的体外肠道培养模型。
CRISPR-Cas这一系统是源于细菌中的一种后天免疫系统。该系统可以把侵入细菌的噬菌体遗传物质整合到自身基因组一个或者多个CRISPR位点作为永久的“记忆”,当细菌被再次入侵的时候,CRISPR位点被转录生成CRISPR RNAs(crRNAs)。crRNA随后会引导DNA剪切酶Cas9根据序列互补的原则剪切入侵的外源核酸序列,消灭外来遗传物质,发挥保护功能。简而言之,源于CRISPR-Cas系统的基因组编辑技术被工程化为一段介导定位作用的RNA序列(guide RNA和crRNA合二为一的杂合RNA序列,称为sgRNA)加上一个DNA水解酶Cas9 组成的二元系统。研究者把这一系统工程化成可以用于编辑哺乳动物细胞的CRISPR-Cas系统,具体包括适于哺乳动物表达的Cas9基因和定位作用的sgRNA(图 1)。
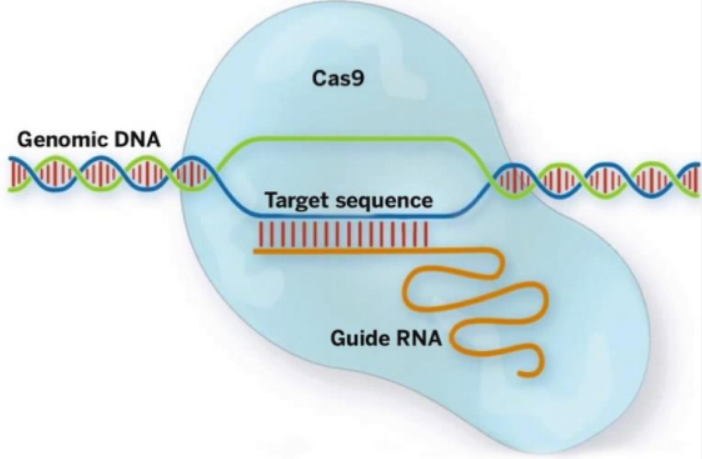
sgRNA设计原理(guide RNA,导向RNA)
sgRNA序列是由17-20bp碱基序列组成,其序列与编辑位点的核苷酸序列互补配对,但前提是靶向区域存在PAM序列,所以设计sgRNA后面带有PAM序列(NGG)。当sgRNA与靶向片段配对后,cas9蛋白就会在PAM序列前3个核苷酸位置对DNA双链进行切割,形成双链断裂(DSBs),随后激活内源性DNA修复系统。在没有同源模板的情况下,DSBs可以通过将两端连接在一起进行修复,称为非同源末端连接(nonhomologous end-joining, NHEJ)。这种方式通常会产生沉默突变,前提是切口干净,不改变基因功能,但又失去被Cas9-sgRNA复合体再次识别的能力,在某些情况下,修复是不完美的,导致碱基对的删除或插入(indels),产生移码突变,通过偶然产生早期终止密码子截断目标基因。此外,如果两种等位基因都发生了框移导致的截断,那么在宿主基因组中该基因将会丧失功能或被敲除。
西安齐岳生物可提供的质粒构建服务包括:
(1)过表达质粒构建;
(2)诱导基因的定点突变;(单碱基突变,多碱基突变)
(3)构建基因截短体质粒;
(4)亚克隆质粒构建;
(5)通过慢病毒介导的基因过表达;
(6)通过构建shRNA慢病毒质粒实现基因的敲减
(7)通过CRISPR-Cas9技术实现基因敲除
注意事项:
本产品仅供科研使用,严禁用于人体或其他非科研用途。
使用过程中请佩戴手套和护目镜等防护用品,避免直接接触皮肤和眼睛。
请按照相关文献和相关安全规定进行操作,避免误用或滥用。如有侵权,可联系我们删除




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询