贵金属纳米材料尤其是金(Au)和银(Ag)纳米材料,由于其具有独特的光学和电子特性,为实际生物医学应用开辟了多种机会,如诊断,**,和传感等应用.一般来说,Ag纳米材料与Au相比,具有更强的等离子体特性.然而,Ag纳米材料在生物医学方面的应用却远远少于Au纳米材料,因为它们的化学稳定性和生物相容性较差。Ag纳米材料表面易于被氧化,会降低其等离子体的性能,释放对生物体有害的Ag离子(Ag+)。虽然Ag纳米粒子表面上可以修饰各种无机或有机表面层来克服这些缺点,但Ag表面仍然容易受到生物介质中蚀刻剂的影响,而厚厚的覆盖层也会降低其原有的等离子体性.因此,必须对Ag纳米粒子进行安全性设计,一方面降低Ag+从Ag纳米粒子表面释放,另一方面保留其等离子体特性用于生物医学应用。目前已经提出了多种安全设计方法开发更安全的纳米材料,包括包覆,装载,嫁接等方法。然而,有害物质(例如,聚合物降解产物和离子)释放或从纳米复合物中解离仍然可能引起一些毒副作用.因此,通过精细调节Ag纳米材料的电子结构可能是一种基本且**的方法,免除了复杂的表面后修饰,同时保留了它们所需的功能。
在Au@Ag核壳结构纳米粒子中,由于Au比Ag具有更大的功函,Ag壳中的银原子易于失去电子并流向Au核。随后,Au和Ag之间的电子不平衡被校正,Au将电子又补偿给Ag,导致Au的d轨道电子消耗而Ag中d轨道电子的增加。这种电子补偿效应在Au和Ag的界面处尤其为**。虽然这种电子补偿机制的根本原因尚不清楚,但Ag侧电子富集的事实可用于**Ag氧化和减少Ag+释放,使得Au@Ag核壳结构纳米粒子能够替代Ag纳米粒子被更为广泛的安全性使用。在同一尺寸的Au纳米粒子上包覆不同厚度的Ag壳,合成了四种不同Ag壳厚度的(2.4,5.1,7.9和10.1 nm)的Au@Agx核壳结构纳米粒子(x代表Ag壳的厚度),研究在不同核壳比的条件下电子的补偿能力(图1a),Ag+释放能力(图1b)及其对细胞和生物体活性的影响(图1c),筛选出具有生物安全性的核壳比,使得Au@Ag核壳结构纳米粒子能够替代Ag纳米粒子被更为广泛的安全性使用(图1d)。

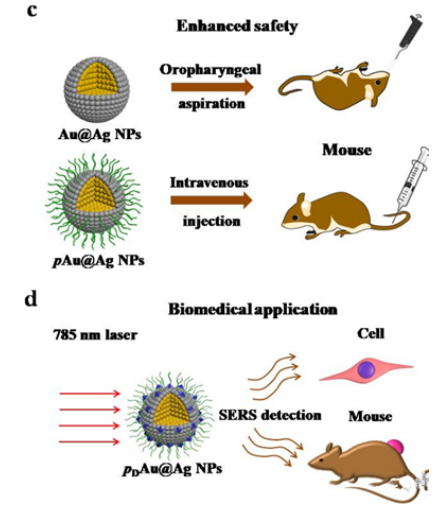
图1.电子补偿效应有助于Au@Ag NPs的安全性和生物医学应用。(a)电子补偿效应发生在Au和Ag原子的界面处,其中Au原子**接受来自Ag原子的非d轨道的电子,然后再向Ag原子的d轨道提供更多的电子;(b)Ag壳变薄,补偿效应增强,Ag表面氧化减弱,Ag+解离降低;(c)通过对裸的Au@Ag NPs进行呛肺实验和对PEG修饰的Au@Ag核壳结构纳米粒子(pAu@Ag NPs)进行静脉注射方法对Au@Ag NPs进行安全性评估;(d)Au@AgNPs用DTTC和PEG修饰后,用于体外和体内的基于SERS的安全性生物医学应用。
Au@Agx核壳结构纳米粒子中Au与Ag之间的电子补偿效应可以使Ag壳表面富集电子,这种电子富集可以**表面Ag氧化并减少Ag+释放,同时保持其等离子体特性。为了筛选出具有生物安全性的核壳比,作者合成了四种不同Ag壳厚度的(2.4,5.1,7.9和10.1nm)的Au@Agx核壳结构纳米粒子(图2)。
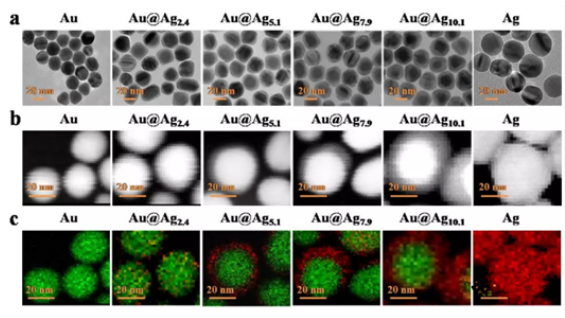
图2.Au,Au@Agx和Ag纳米粒子的(a)透射电子显微镜图片;(b)STEM 图片;和(c)元素扫描图。
为了验证Au与Ag之间的电子补偿行为,通过X射线光电子能谱(XPS)和X射线吸收近边结构(XANES)分析手段来进行分析。图3(a),(b)发现Ag 3d3/2和3d5/2峰向较低的结合能移动,而Au 4f5/2和4f7/2峰向更高的结合能移动,这意味着Ag壳接受电子,而Au核则更多地贡献电子。该结果表明从Au核到Ag壳发生了电子补偿现象,并且在具有薄壳层的Au@Ag2.4纳米粒子中产生**的补偿效果。通过收集Au箔,Au和Au@Ag核壳结构纳米粒子的AuL2近边XANES光谱(图3c),作者发现,随着Ag壳变薄,Au@Ag核壳结构纳米粒子显示出逐渐增强的白线强度。因为白线峰与未被电子占据的d轨道直接相关,所以白线强度增强表明d轨道电子给予行为。Au核的d轨道电子给出后可以产生d轨道空穴,其数量可以根据L2和L3近边XANES光谱得到的参数计算得出。
图3d显示了空穴数(Δh3/2 +Δh5/2)变化,其中具有薄Ag壳的Au@Ag2.4核壳结构纳米粒子显示出明显的空穴数,其次是Au@Ag5.1,Au@Ag7.9,和Au@Ag10.1核壳结构纳米粒子。Au的XANES分析结果表明Au核将d轨道电子转移到Ag壳,壳层越薄,电子转移的越多。Au核的电子给予可以促进Ag壳中的电子富集,从而**Ag壳表面被氧化。作者收集了Ag K边XANES光谱(图3e)以表征Ag和Au@Ag核壳结构纳米粒子中Ag元素的氧化状态.Ag箔和Ag2O作为参考样品用于拟合XANES结果。基于较小二乘拟合(分析,发现Ag 纳米粒子中的Ag元素含量为89.46%,Ag2O含量为10.54%,但是Au@Ag2.4,Au@Ag5.1,Au@Ag7.9,和Au@Ag10.1核壳结构纳米粒子中的元素Ag含量分别为99.98%、99.06%、97.27%和92.19%。很显然,薄银壳可以很好地防止氧化。而Au@Ag核壳结构纳米粒子****Ag壳氧化的结果可能会导致低的Ag离子解离。通过ICP-OES分析Ag和Au@Ag核壳结构纳米粒子在BEGM培养基中解离银离子的能力。结果表明,Ag纳米粒子在BEGM培养基(图3f)中具有高水平的Ag离子解离,而在Au@Agx核壳结构纳米粒子中,随着Ag壳变薄,银离子解离水平逐渐降低。
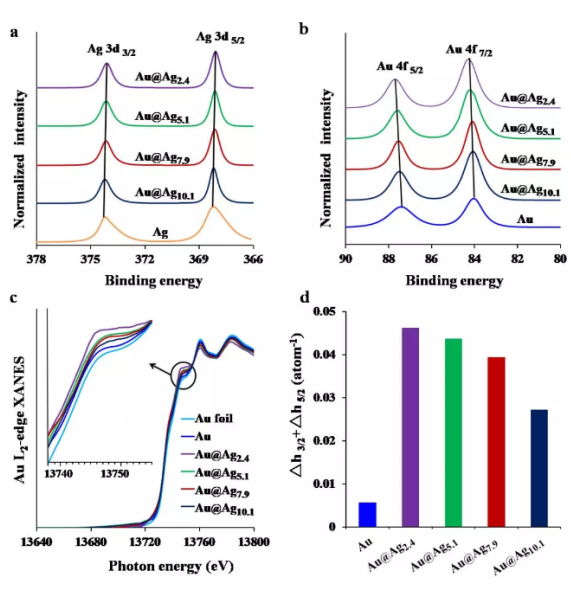
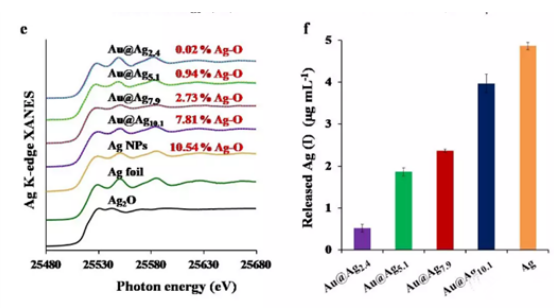
图3.(a)Ag 3d XPS光谱;(b)Au 4f的XPS光谱;(c)Au箔,Au和Au@Ag核壳结构纳米粒子的AuL2近边XANES光谱;(d)Au和Au@Ag核壳结构纳米粒子的d轨道空穴数(Δh3/2 +Δh5/2);(e)Ag箔,Ag2O,Ag和Au@Ag核壳结构纳米粒子的K边XANES光谱;(f)Ag和Au@Ag核壳结构纳米粒子在BEGM培养基中解离银离子的能力。
在不同的细胞和小鼠模型中评估了裸的Au@Ag核壳结构纳米粒子和聚乙二醇(PEG)修饰的Au@Ag核壳结构纳米粒子(pAu @Ag NPs)的生物安全性。实验发现裸Au@Ag2.4NPs在各种Au@Agx NPs中显示出较低的Ag+释放,并且对人上皮细胞(BEAS-2B),小鼠肺泡巨噬细胞(RAW 264.7)和急性肺炎小鼠模型产生较小的毒性和炎症反应。而且,PEG修饰后的Au@Ag2.4 NPs,对人肝细胞(L02),肾细胞(HEK293T)和静脉注射后对Balb/c小鼠也显示无毒性,证实其很好的安全性。由于等离子体纳米粒子的电磁场驱动的表面增强拉曼散射(SERS)效应对生物传感和疾病诊断非常有益,因此,通过与近红外拉曼分子-二乙基硫吖啶羰基碘(DTTC)偶联来研究Au@Ag核壳结构纳米粒子的SERS效应(图4)。结果发现,pAu@Ag2.4 NPs连接DTTC后(pDAu@Ag2.4 NPs),体外和体内SERS信号比纯Au或Ag NPs更强,证明安全的Au@Ag核壳结构纳米粒子的潜在生物医学应用。
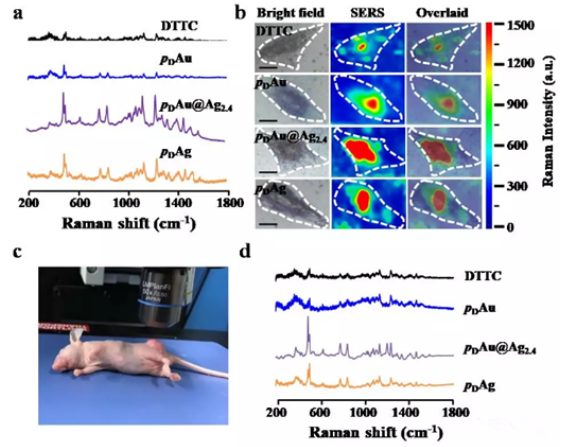
图4.(a)DTTC分子,pDAu,pDAg和pDAu@Ag2.4纳米粒子的拉曼光谱;(b)用DTTC分子,pDAu,pDAg和pDAu@Ag2.4纳米粒子处理过的MCF7细胞的明场图像,拉曼图像以及二者相覆盖后的图像;(c)用785 nm激光照射带有MCF7**的Balb/c裸鼠**部位的照片;(d)对带有MCF7**的Balb/c裸鼠静脉注射DTTC分子,pDAu,pDAg和pDAu@Ag2.4纳米粒子24小时后收集的**部位的拉曼光谱。
我们公司可以提供金纳米簇/金纳米球/金纳米笼/金纳米壳/金纳米星/金纳米三角片/金纳米线/金纳米球/金纳米棒等等金系列产品。
我们可以对这些金纳米产品进行功能化,我们可以在这些金材料上修饰氨基 醛基 羟基 羧基 马来酰亚胺 生物素Alkyne 叠氮 Alkyne炔烃,Amine氨基,Azide叠氮,Biotin生物素,Carboxyl羧基,Methyl甲基,NHS活化脂,Maleimide马来酰亚胺,Hydroxyl羟基,Thiol巯基,我们还可以在纳米金球/纳米金棒/金微球/金纳米线上修饰这些蛋白Neutravidin中性亲和素,GSH谷胱甘肽,Streptavidin链霉亲和素,ProteinA蛋白A,磷脂产品、Galactose半乳糖,BSA牛血清白蛋白、PEI修饰、RGD修饰,叶酸修饰,PAA聚合物 葡聚糖、壳聚糖、海藻酸钠、半乳糖、DOTA、转铁蛋白和二氧化硅均可以修饰纳米金及纳米金棒产品。
介孔二氧化硅包裹的正电荷纳米金
聚乙烯亚胺/聚乙二醇修饰纳米金颗粒
负载钆钆螯合剂DOTA-NHS的树状大分子包裹的纳米金颗粒
环糊精修饰的树状大分子包裹的纳米金
聚乙二醇化树状大分子包裹的纳米金颗粒
RGD多肽修饰的多功能树状大分子包裹的纳米金颗粒
透明质酸包裹的金纳米粒子
壳聚糖包裹纳米金粒子
泛影酸/叶酸修饰的多功能树状大分子包裹的纳米金颗粒Au DENPs
靶向脂质体包裹水相纳米金复合物
壳聚糖改性聚氨酯及壳聚糖包裹纳米金
叶酸修饰的多功能靶向造影剂磁性氧化铁/金纳米颗粒
叶酸修饰的复合泛影酸的聚酰胺-胺树状大分子金纳米粒子
柠檬酸根包裹的纳米金颗粒
金纳米颗粒功能化二硫化钼纳米复合材料
溶菌酶功能化金纳米颗粒材料
鲁米诺及衍生物功能化的金纳米材料
DNA功能化的金纳米颗粒
苝酰亚胺功能化的金/银纳米颗粒
杯芳烃功能化金纳米颗粒
赖氨酸修饰的苝酰亚胺功能化金纳米颗粒
多层壳包覆的功能化金纳米颗粒
乳糖酸修饰的低代数PAMAM包裹金纳米颗粒
硫辛酸功能化的金纳米颗粒
树枝化聚苯/金复合纳米粒子
功能化Pd@Au纳米颗粒
抗氧化配基功能化的金纳米复合物
功能化金刚石纳米颗粒
多肽功能化金纳米颗粒
纳米金颗粒包裹的PEG功能化PAMAM树状大分子
金纳米颗粒修饰的硫酚功能化石墨烯复合材料
叶酸修饰的多功能靶向造影剂磁性氧化铁/金复合纳米颗粒
三联吡啶衍生物配体与β-二酮稀土配合物包覆金纳米颗粒
金纳米颗粒修饰的多壁碳纳米管(MWCNTs)
多官能团表面修饰金属纳米颗粒
碳纳米管/聚苯胺/纳米金复合材料
配位键修饰的功能性纳米颗粒/氧化石墨烯纳米杂化材料
牛血清白蛋白修饰纳米金颗粒
金纳米颗粒功能化还原氧化石墨烯(RGO)和多壁碳纳米管(MWCNTs)
铂修饰的枝状金纳米复合材料
C18键合纳米金修饰二氧化硅颗粒
石墨烯(GS)-壳聚糖(CS)-纳米金(Nano-Au)复合材料
纳米金(Au)包被瘦肉精-牛血清蛋白(CLB-BSA)
纳米金修饰羧甲基壳聚糖
纳米金修饰乙酰胆碱酯酶
柔红霉素修饰的纳米金
金纳米颗粒复合材料(ssDNA-AuNPs);Hyaluronic Acid-DNA透明质酸修饰脱氧核糖核酸
二氧化硅包裹金纳米颗粒
氨基、羧基功能化的纳米金试剂
PEG包裹的纳米金颗粒(PEG末端链接不同基团)
BSA包裹的纳米金颗粒
葡聚糖包裹的纳米金颗粒
氨基功能化的金纳米粒子
羧基功能化的金纳米粒子
聚乙烯亚胺包裹纳米金(PEI-nanogold)
氧化气氛下氧化钛包裹金纳米颗粒
金纳米离子包裹二氧化硅壳核材料
红细胞膜包被金纳米颗粒
11-巯基十一烷酸包裹的金纳米颗粒
单分散性PEG修饰金纳米颗粒
纳米金颗粒标记外泌体
葡萄糖包被的纳米金颗粒(Gold Nanoparticle, GNP)
纳米金颗粒标记外泌体
氧化硅修饰的纳米金
D-丙氨酰-D-丙氨酸(D-alanyl-D-alanine,DADA)修饰金纳米颗粒(Au_DADA)复合材料
四面体DNA修饰金纳米颗粒上合成Au-TDNNs复合材料
精氨酸/氨基酸修饰金纳米颗粒
富勒醇修饰的金纳米颗粒
肽修饰的金纳米颗粒
FITC/羧基官能化修饰金纳米颗粒
CY3/FITC/马来酰亚胺功能化金纳米颗粒
CY3和羧基官能化金纳米颗粒
FITC和叠氮功能化金纳米颗粒
Cy3和NHS功能化金纳米颗粒
FITC和甲基功能化金纳米颗粒
FITC和生物素功能化金纳米颗粒
Cy3和蛋白A功能化金纳米颗粒
金纳米粒子修饰黑磷纳米片
精氨酸-甘氨酸-天冬氨酸RGD修饰的金纳米颗粒
三缩乙二醇聚谷氨酸酯修饰金纳米颗粒
氨基糖修饰金纳米颗粒复合材料
钯原子Pd修饰Au纳米粒子
谷胱甘肽包裹的银纳米粒子AgNPs (GS-AgNPs)复合材料
柠檬酸根修饰的银纳米颗粒
月桂酸钠修饰纳米银颗粒
聚苯乙烯包覆银纳米颗粒
有机酸银包覆纳米银颗粒
聚乙烯亚胺(PEI)功能化的银纳米颗粒
银纳米颗粒包裹二氧化硅微球粉末
硫醇包裹的银纳米粒子
纳米银颗粒包裹碳纳米管材料(CNTs@Ag)
纳米银包裹的聚苯乙烯微球(PS)复合材料
纳米银修饰的聚偏氟乙烯纳米纤维
二氧化硅包覆的银纳米颗粒
银纳米颗粒(AgNP)标记AFB 1-牛血清白蛋白(AFB 1 -BSA )共轭物
改性金属-有机骨架(MOF)/银纳米粒子(AgNPs)/核桃壳生物质碳(BC)的纳米复合材料BC/Cr2O3/Ag
银纳米颗粒(AgNPs)改性的聚酰胺(TFC-FO)膜
银纳米颗粒修饰的还原氧化石墨烯(Ag-rGO)
β-环糊精修饰的银纳米颗粒
zzj 2021.3.18




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询