通过引入蛋白酶激活RNA聚合酶(PR),构建了一种基于蛋白水解激活转录和CRISPR-Cas12a的蛋白酶检测新方法。在该方法中,目标蛋白酶通过特异性水解多肽从而解除对T7 RNA聚合酶转录活性的**,实现蛋白酶信号到gRNA信号的放大转换,随后在dsDNA存在条件下激活Cas12a的附属切割活性,水解底物探针产生可检测的荧光信号,实现目标蛋白酶两步放大检测。通过引入PR,该方法不仅成功的为蛋白酶高灵敏检测提供新的思路同时还将CRISPR-Cas12a成功应用于蛋白酶生物标志物的检测。
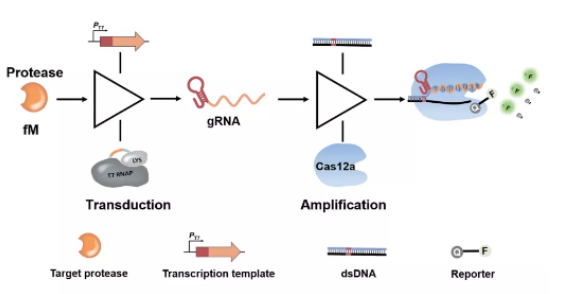
PR-Cas用于蛋白酶检测的示意图:以gRNA为桥梁,当目标蛋白酶存在时,其能特异性水解T7 RNA聚合酶和溶菌酶之间的底物多肽,恢复T7 RNA聚合酶的转录活性,从而成功的将蛋白酶信号转换为多个可被Cas12a识别的gRNA。在dsDNA存在的条件下,转录产生的gRNA能够**激活Cas12a的酶切活性,产生可测得的荧光信号,实现对蛋白酶的**检测。
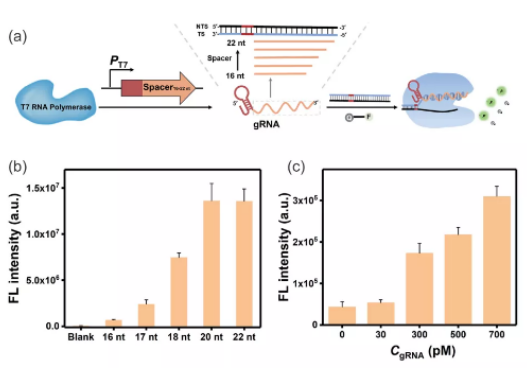
图1:(a)T7 RNAP介导的转录与CRISPR-Cas12a偶联的示意图。(b)不同gRNA引导序列长度对Cas12a非特异性切割活性的影响:结果表明当用到序列长度为20 nt时可以充分激活Cas12a的非特异性切割活性。(b)Cas12a对低浓度gRNA的响应。
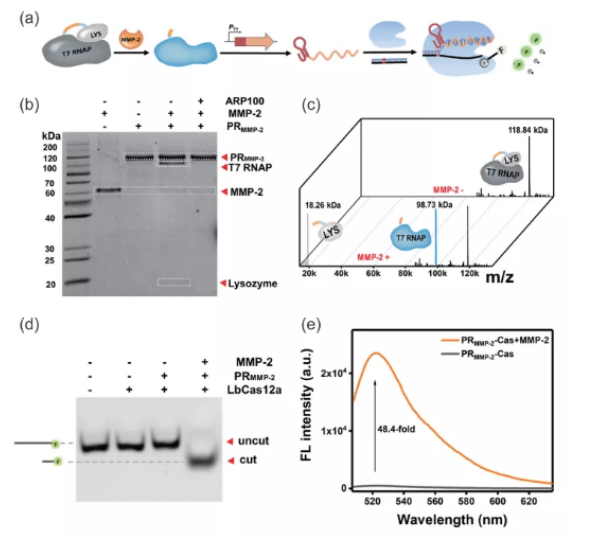
图2:(a)PR-Cas检测MMP-2的示意图。(b)SDS-PAGE表征PRMMP-2的酶切。(c)MALDI-TOF MS表征MMP-2对PRMMP-2的酶切。(d)PAGE凝胶电泳表征MMP-2对LbCas12a非特异性切割活性的调控。(e)PR-Cas对MMP-2的荧光响应。
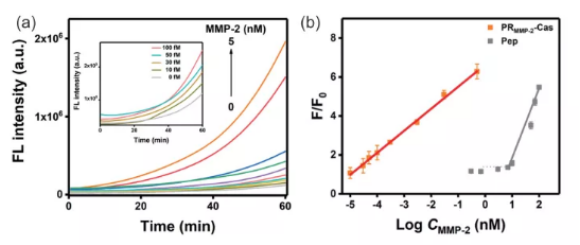
图3:(a)PRMMP-2-Cas对不同浓度的MMP-2的荧光动力学曲线。(b)PRMMP-2-Cas和Pep对不同浓度MMP-2响应的校准曲线。

图4:(a)PR-Cas检测凝血酶的示意图。(b)PR-Cas对MMP-2的荧光响应。(c)PR-Cas对凝血酶的特异性考察。

图5:(a)PRMMP-2-Cas检测细胞培养基上清液和血清样品中的MMP-2活性原理图。(b)归一化荧光强度表征PRMMP-2-Cas对不同细胞培养基上清的荧光响应。(c)归一化荧光强度表征PRMMP-2-Cas对血液样本中MMP-2的响应荧光响应。
利用PR的信号转换能力,可以将靶标蛋白酶信号转换为多个可以激活CRISPR-Cas12a非特异性切割活性的gRNA,从而实现对蛋白酶的两步放大检测。此外,基于PR-Cas的可编程性,可以通过改变PR的底物多肽便可实现蛋白酶的通用化检测。PR-Cas的成功构建不仅拓展了CRISPR-Cas系统在蛋白酶检测领域的应用,还为蛋白酶生物标志物的高灵敏检测提供了新的策略在生化研究和临床诊断中具有广阔的应用前景。
相关列表
PAPI改性大豆蛋白复合材料
磷酸盐/酵母蛋白纳米复合材料
FITC标记的丙型肝炎病毒非结构蛋白5A反式激活蛋白9抗体
PE-Cy5标记的丙型肝炎病毒非结构蛋白5A反式激活蛋白9抗体
HRP标记抗体,丙型肝炎病毒非结构蛋白5A反式激活蛋白9抗体
CIITA II型反式激活蛋白,Mouse IgG1 anti-Human,WB/IP
金纳米团簇碳纳米管血红蛋白
壳聚糖-磷酸钙/重组人骨形态发生蛋白2复合材料
人血清蛋白-无机纳米复合材料
氧化石墨烯重组链球菌蛋白G复合物材料
羊毛角蛋白/氧化石墨烯复合材料
基于金属—有机骨架材料及石墨烯的C-反应蛋白
HIV-1反式激活蛋白-血红素氧合酶-1融合蛋白
DNA聚合酶反式激活蛋白1(HBVDNAPTP1)
苝二酰亚胺衍生物-聚苯胺-氮化碳非标记型C-反应蛋白
青蛙卵状结构的Li_3V_2(PO_4)_3/C复合材料
反式转录激活蛋白(TAT)肽修饰的纳米载体
反式激活蛋白(TAT)和或2,3-二甲基马来酸酐(DA)修饰的聚乙二醇-b-聚乳酸共聚物(PEG-b-PLGA)纳米**
反式激活反应-DNA结合蛋白(TAR DNA-binding protein 43,TDP43)
含肽修饰的蛋白酶
反式蛋白接枝聚乙二醇(PEG))修饰粒细胞集落刺激因子(G-CSF)
双向电泳糖基化修饰目的使用全反式视黄酸(all-trans retinoic acid,atRA)
单甲氧基聚乙二醇修饰化的蛋白酶
反式激活蛋白TAT片段短肽(RKKRRQRRR)偶联于聚乙烯亚胺-β-环糊精
组蛋白及非组蛋白的乙酰化修饰
zzj 2021.3.26




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询