黑磷纳米片(BPNS),是一种生物兼容且可降解的二维纳米材料。作为一种光热剂,目前已被广泛应用于前临床**光热**。但是,BPNS是一种对水-氧环境易感的材料,在体内会快速被降解成磷氧化合物(PxOy), 从而失去光热**性能。尽管目前已有多种通过对BPNS进行共价或者非共价的修饰方法被报道,基于此,对黑磷的光热稳定性进行改善,但是,这种改善是以损失**的降解性能作为代价。如何在不损失BPNS的降解性能的基础上,能够同时提升BPNS的光热性能和**效果,是科学家追求的目标之一。
我们将二价金属铜离子(Cu2+)与BPNS进行有机结合,实现了“一举多得”的效果。该设计的优势主要表现为:
(1) BPNS可以**负载Cu2+;
(2)基于Cu的纳米材料(如硫化铜纳米颗粒)是良好的光热剂,因此,BPNS 与 Cu 可以实现协同光热作用,进一步提升光热**性能;
(3)Cu(II) 可以与P(0) 发生氧化还原反应,从而促进BPNS的降解;
(4)反应生成的Cu(I)离子是一种类Fenton 反应催化剂,可以与**微环境中的H2O2发生反应,从而产生高浓度的•OH自由基,对**细胞进行杀伤,进而实现化学动力学**(Chemodynamic therapy)联合的光热**;
(5) Cu-64是一种常用的对纳米药物进行示踪的正电子发射核素,可以用于正电子发射断层扫描成像(PET)和β-线**,目前已用于多项临床研究。
本设计中,通过对BPNS进行Cu-64标记,不会改变纳米药物的本来的结构,从而实现了对纳米药物的体内动态和代谢的示踪和反映。与传统的光学成像(如近红外,光声成像)相比,具有可全身动态监测,定量计算,临床实践零距离等多方面的优势,为未来基于BPNS的纳米**的临床转化奠定了基础。
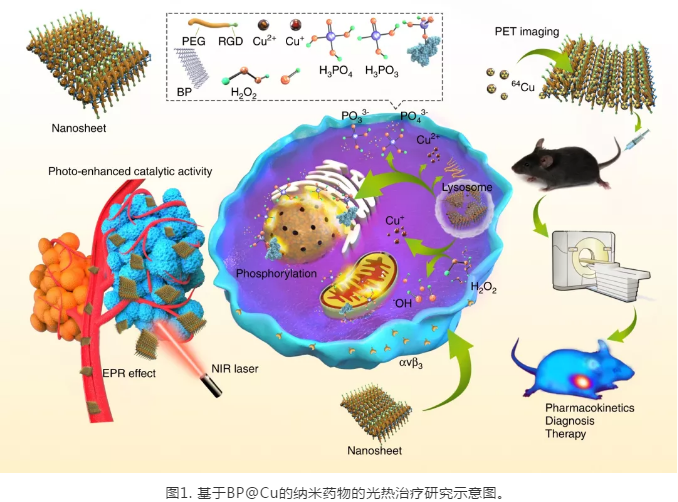
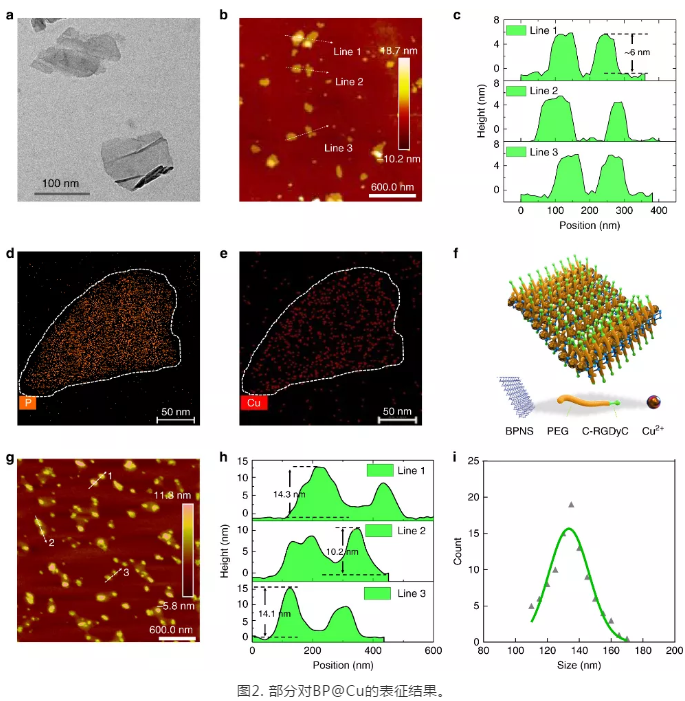
在实验结果部分,**研究了BPNS与Cu(II)之间的相互作用,通过一系列表征手段,如TEM, AFM, UV-VIS-IR,Raman, XPS, EPR等,证实了BPNS 与 Cu(II) 发生了氧化还原反应,生成了Cu(I)。随后,研究了BP@Cu 复合材料的光热性能,结果表明:Cu(II)与BPNS 产生了光热效果协同作用,在808 nm的激光照射下,BPNS@Cu释放出更多的热量。为了提升BP@Cu的体外稳定性,进一步用PEG对BP@Cu进行了包裹,并在表面修饰了整联素蛋白(integrin αvβ3)的靶向多肽(cyclo-RGD)。随后,选取了多种**细胞对BP@Cu@PEG-RGD的生物学效应进行了评价。结果显示:负载了Cu(II)的BPNS具有比BPNS更好的**细胞杀伤效果。在随后细胞作用机制研究中,证实了BP@Cu诱导了**细胞内更高的活性氧(ROS)水平,从而使**细胞发生凋亡和细胞周期**。
完整的体内药代动力学和代谢排泄途径的研究,是纳米药物进行临床实验前不可缺少的重要一环。与其他纳米药物类似,BP@Cu@PEG-RGD 通过尾静脉注射以后,会迅速被肝脏和脾脏吸收,但是随着BPNS的缓慢降解,这些纳米**的尺寸会逐步缩小,并**从脾脏和肝脏逃逸,重新进入血液循环。**随着不断降解,部分BPNS将会被肾脏-膀胱通路排出体内。我们还考察了BP@Cu@PEG-RGD的**富集能力。在多种皮下**模型中,BP@Cu@PEG-RGD展现出在**组织的不断累积作用,并在18小时左右达到最高点。这些结果为随后施加光热**和制定给药方案提供了重要的参考。
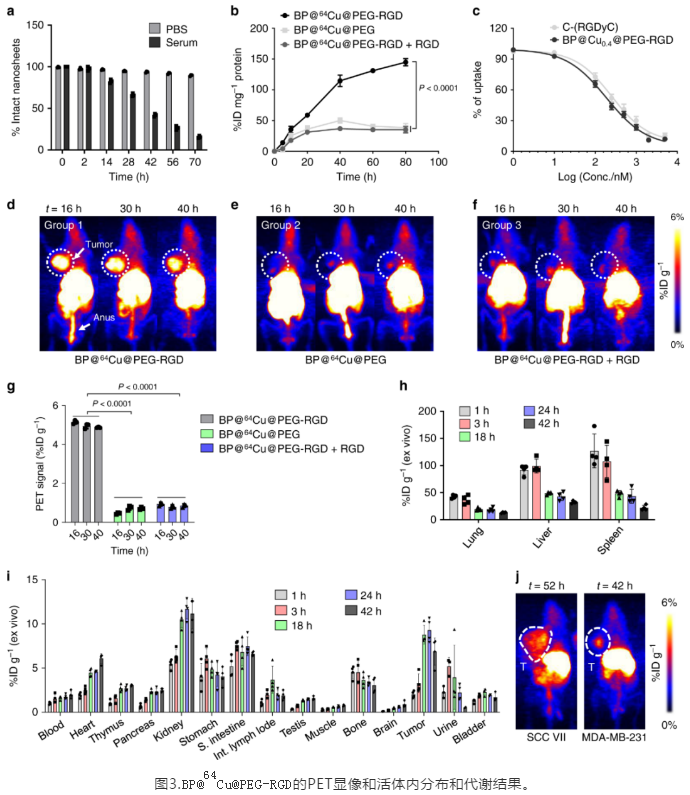
最后,研究BP@Cu纳米药物的****效果。结果表明,通过尾静脉注射纳米药物,并在808 nm 激光的照射下,BP@Cu0.4@PEG-RGD **的**几乎被完全**。形成鲜明对比的是,BP@Cu0.4以及BP@Cu0.4@PEG **的****效果不佳。这是由于BPNS 在**部位的富集主要是由RGD 介导。**,用PET评价了**效果,并进一步强调了PET作为诊断方法在纳米**开发和**效果评价方面的重要作用。
西安齐岳生物提供定制黑磷纳米复合材料的相关定制产品,现将产品目录展示如下:
氮川三乙酸-镍修饰黑磷纳米片复合载药材料NTA-NI-BPNSs
雷替曲塞修饰黑磷纳米片复合载药材料Raltitrexed-BPNSs
聚N-异丙基丙烯酰胺包裹黑磷量子点PNIPAAm-BPQDs
二硫键-聚乙烯亚胺包裹黑磷量子点PLA-SS-PEI-BPQDs
四甲基罗丹明聚乙二醇标记黑磷(BP)纳米片TRITC-peg-BP




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询