酰腙Schiff碱的[Cu(L)(Phen)]·1/4H2O (1)|(二乙胺基)水杨醛缩异烟酰腙/邻菲罗啉铜配合物
摘要
摘要:在甲醇和DMF混合溶剂中合成了一种酰腙Schiff碱的铜配合物[Cu(L)(Phen)] ·1/4H2O (1),其中H2L=4-(二乙胺基)水杨醛缩异烟酰腙,Phen=邻菲罗啉,经元素分析、红外光谱、紫外光谱、热重分析和X-射线单晶衍射分析进行了表征。1的晶体属单斜晶系,P21/n空间群,晶胞参数a = 1.376 4(2) nm,b = 1.058 18(18) nm,c =1.6997(3) nm,α = 90)°,β = 93.244(3)°,γ = 90°,V = 2.471 6(7) nm3;Cu(II)处于四方锥配位环境,配合物通过分子间π…π和C-H̵̵̵̵̵̵…π相互作用形成一维链状超分子。
铜是生物体内必需的微量元素,是一些重要酶的活性中心,它与有机配体形成的配合物广泛存在于生命体中,参与电子传递、氧化还原等生命过程,许多铜配合物具有抗菌、抗病毒、抗炎、抗**、酶**等许多特殊的生物活性[1-7]。而铜离子配位构型的多变性,更使其配合物结构异彩纷呈。酰腙类Schiff碱不仅具有易于控制的空间构型、多齿的配位能力和很高的稳定性,还具有独特的光、电、磁等物理材料性能以及良好的生物活性[8-14]。因此研究酰腙Schiff碱铜配合物具有重要的意义。4-(二乙胺基)水杨醛缩异烟酰腙(H2L)是一种四齿Schiff碱,目前与之相关的配合物的报道还很少[15],作为我们研究工作的延续,本文以邻菲罗啉为**配体合成了一种铜三元配合物[Cu(L)(Phen)]·1/4H2O,报道了它的光谱性质、热稳定性和晶体结构。
1 实验部分
1.1 仪器与试剂
德国Elmentar Vario EL元素分析仪;美国Nicolet公司is10型FT-IR红外光谱仪;上海美普达UV-1800PC型紫外-可见分光光度计;德国塞驰STA 409 PC型综合热分析仪;德国Bruker Smart Apex CCD单晶衍射仪。所用试剂均为分析纯试剂,4-(二乙胺基)水杨醛缩异烟酰腙(H2L)按[15]方法制备。
1.2 配合物1的合成
将0.2 mmol邻菲罗啉和0.2mmol的酰腙配体H2L溶于5 mL甲醇和5mLDMF的混合溶剂中,0.2 mmol的Cu(CH3COO)2 ·H2O溶于10mL甲醇,将上述溶液置于50ml的圆底烧瓶中,于60℃加热搅拌2h,冷却至室温,过滤,滤液静置一周后析出黑色块状晶体。对4(C29H26N6O2Cu)·H2O的元素分析实测值(理论值),%:C,62.33(62.36);H,4.65(4.69);N,15.11(15.05)。IR (KBr,σ):3411,2964,2926,1589,1511,1496,1428,1401,1355,1246,1212,1138,956,856,828,723,691 cm-1。
1.3 晶体结构测试
选取1的0.20 x 0.22 x 0.24 mm单晶置于Bruker Smart Apex CCD单晶衍射仪上, 用经石墨单色器单色化的Mo Kα射线(λ=0.071073 nm)在1.85°<θ<26.00°范围内以φ~ω扫描方式于291(2)K下收集18 865个单晶衍射数据,4 831个独立衍射点(Rint=0.023),其中I>2σ(I)的可观察点3 655个。数据还原和解析分别用SMART和SHELXTL程序包[16]完成,晶体结构由直接法解出。对全部非氢原子坐标及其各向异性热参数进行全矩阵较小二乘法修正,氢原子由理论加氢法得到,并进行各向同性精修。晶体学数据详见表1。
表1 配合物1的晶体学数据
Table 1 Crystallographic data for 1

2 结果与讨论
2.1 [Cu (L) (Phen )]·1/4H2O的晶体结构描述
配合物1的分子结构见图1,主要键长及键角数据见表2。配合物1的配位单元是一个电中性分子,它由1个中心离子Cu(II)、1个邻菲罗啉(Phen)和1个负二价的酰腙配体L2-组成。Cu(II)的配位数为5,与配原子形成畸变的四方锥配位几何构型CuN3O2,其中2个N来自Phen,1个N来自酰腙配体的亚胺基,1个O来自酚盐氧,1个O来自酰胺基(-CONH-),酰胺基烯醇化并脱除质子从而维持与金属离子的电荷平衡。O1、O2、N2和N5位于锥底组成四边形,N5-O1 -N2-O2扭转角为4.06°,键角为80.86(11)~ 93.09(11)°和167.09(10)~ 171.02(12)°;N1位于锥顶,与邻位原子组成的键角为77.65(11)~ 108.07(12)°。O1-C18-N4-N5-Cu1组成稳定的五元环,N5-C19-C20-C25-O2-Cu1组成稳定的六元环, Cu-O键长为0.1922(2)~ 0.1957(2) nm,Cu1-N5键长为0.1912(3) nm,都在正常范围内,而N1-C12-C11-N2-Cu1组成稳定的五元环,Cu-N键长为0.2028(3)~ 0.2244(3) nm。
酰腙配体由于以烯醇式配位而使整个配体形成一个庞大的共轭体系,C14-C15-C18-N4 和C16-C15 -C18 -O1扭转角分别为1.5(5)和1.3(5)°,C18-N4-N5-C19扭转角为174.1(3)°,N5-C19-C20-C25扭转角为-5.9(6)°,C26-N6-C23-C22和C28-N6-C23-C24扭转角分别为3.1(5和7.0(5)°,吡啶环与苯环二面角约为13.5°。由于二乙胺基与苯环共轭,N6 -C23键长(0.1361(4) nm)呈现双键特征,与吡啶环中C=N键长(0.1312(6)~ 0.1322(5) nm)相近。酚羟基脱质子配位后使氧原子O2的杂化轨道类型转变为sp2,O2 -C25键长( 0.1305(4) nm)与双键O1 -C18键长(0.1283(4) nm)接近,比游离配体[15]C-O键长 (0.1360(3) nm)短0.0055 nm。而共轭作用使C15 -C18 (0.1485(5) nm)和C19 -C20 (0.1415(6) nm)小于C-C单键键长。
Phen的所有原子几乎完全共平面,相邻配位单元的Phen的平面质心间距0.34508(5) nm,存在较强的π-π相互作用(图2);同时Phen与另一分子的酰腙配体的苯环之间存在边对面的C-H…π(0.24507 (3) nm)作用。于是,配位单元通过分子间的π-π作用和C-H…π作用联接成一维链状超分子。
表2 配合物1的主要键长及键角
Table 2 Select bond lengths(nm) and bond angles(°) for the 1
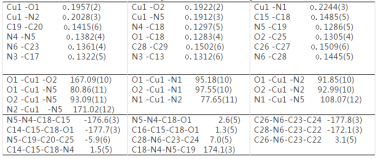
图1 配合物1的分子结构图的分子结构(椭球率30%)
Fig.1 The molecular structure of 1 at 30% probability
Cg1: C7/C8/C9/C10/N2/C11, Cg2: C20/C21/C22/C23/C24/C25
Cg1…Cg1#1: 0.34508(5) nm, C3#2-H3#2…Cg2: 0.24507 (3) nm
#1)1-x,2-y,1-z; #2)1-x,1-y,1-z
图2 配合物1由 π…π和C-H…π作用构筑的一维超分子链
Fig.2 1-D chain supramolecule via π…π and C-H…π interactions in the 1
2.3 红外光谱和电子光谱特征
酰腙配体H2L的IR中1677和1630 cm-1处的强吸收峰分别归属羰基和亚胺基的伸缩振动(n C=O和n C=N), 3161cm-1吸收峰来自酰胺基团N-H的伸缩振动(n NH),形成铜配合物后νC=O和νNH消失,说明酰腙以烯醇式配位,而亚胺基配位导致n C=N红移至1589cm-1;酚羟基的Ar-O伸缩振动由1247 cm-1红移至1246 cm-1;在配合物的IR中1428、828和723 cm-1一组新的吸收峰证明邻菲罗啉参与配位。3400~3500 cm-1区域宽吸收峰属结晶水的特征吸收。
以DMF为溶剂,配制5×10-6mol·dm-3的溶液,扫描得到的电子吸收光谱见图3。酰腙配体H2L在268 nm的吸收带属π→π* 电子跃迁,375 nm属n→π*电子跃迁和分子内电荷转移跃迁(ILCT);形成铜配合物后,n→π*和ILCT电子跃迁红移至416 nm,445 nm肩处的吸收可指认为配体与金属之间的荷移跃迁(LMCT)。
配体:269, 377nm;配合物[Cu (L) (Phen )]·1/4H2O:273, 416, 445 nm(肩)
图3 配体和铜配合物的紫外可见吸收光谱
Fig.3 UV-vis spectra of the ligand and copper(II) complex
2.4 热稳定性
配体室温至102℃失去1个结晶水,失重5.66%(理论值5.45%);278℃开始分解,278-345℃快速失重44.5%,700℃后恒重,残重33.4%。配合物室温至118℃失去结晶水,失重1.2%,(理论失重0.8%),337℃开始分解,337-359℃快速失重41.5%,可能与酰腙配体分解脱除苯环和吡啶片段有关(理论失重42.6%),之后缓慢持续失重,至800℃残重37.9%,残余物可能是金属氧化物和部分积炭。
小编:wyf 05.19
![酰腙Schiff碱的[Cu(L)(Phen)]·1/4H2O (1)|(二乙胺基)水杨醛缩异烟酰腙/邻菲罗啉铜配合物-UDP糖丨MOF丨金属有机框架丨聚集诱导发光丨荧光标记推荐西安齐岳生物](/images/logo.png)



 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询