文献:Redox-sensitive and hyaluronic acid functionalized liposomes for cytoplasmic drug delivery to osteosarcoma in animal models
作者:Yingying Chi a, Xuelei Yin a, Kaoxiang Sun a, Shuaishuai Feng a, Jinhu Liu a, Daquan Chen a, Chuanyou Guo b, Zimei Wu
文献链接:https://www.sciencedirect.com/science/article/abs/pii/S0168365917306922
摘要:
本研究旨在开发氧化还原敏感和CD44靶向的脂质体。制备阳离子脂质体,并用一种新型的可拆卸聚乙二醇(PEG2000)通过生物可还原的二硫化物接头(Chol-SS-mPEG)与胆固醇结合稳定。透明质酸(HA,分子量20-40kDa)是CD44的配体,非共价包覆在阳离子脂质体上。
阿霉素(DOX)作为模型药物被积*负载在脂质体中。研究了HA和Chol-SS-mPEG对细胞内药物递送效率和*肿瘤疗效的作用。Chol-SS-mPEG的结构通过傅里叶变换红外光谱和核磁共振(1H NMR)得到证实。
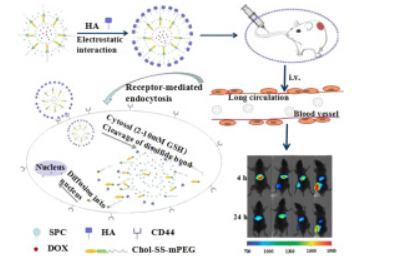
脂质体Chol SS mPEG/HA-L的平均直径为165 nm,ζ电位为-28.9 mV,在还原性或酸性(pH 5-6)条件下不稳定。DOX的体外释放在生理条件下得到了很好的控制,但与非氧化还原敏感脂质体(Chol mPEG/HA-L和Chol-mPEG-L)相比,在10 mM谷胱甘肽(GSH)的存在下观察到60%的突然释放。
MTT细胞活力测定显示,与非还原敏感或非HA包被的脂质体相比,载药量为15.0%(w/w)的双功能Chol-SS-mPEG/HA-L对MG63骨肉瘤细胞具有显著更高的细胞毒性(p<0.01),这与使用共聚焦显微镜和流式细胞术进行的细胞摄取和细胞内运输研究一致。此外,与人肝细胞LO2相比,HA包覆的GSH反应脂质体优先内化到MG63。
在大鼠中,用Chol-SS-mPEG或Chol-mPEG稳定的脂质体,有或没有HA,将DOX的半衰期延长了10倍以上。在MG63异种移植物小鼠模型中,与其他脂质体相比,Chol SS mPEG/HA-L显示出有效的肿瘤抑制作用,肝脏的摄取量小。
与游离DOX治疗的动物相比,所有用脂质体制剂治疗的动物都存活了下来。总之,易于制备的Chol-SS-mPEG/HA-L被证明是一种CD44介导的细胞内递送系统,能够长循环和GSH触发的细胞质药物释放。
相关推荐:
COOH-PEG-PLA(10K)
PLGA(8K)-PEG-COOH
NO2-Bn-PEG-COOH
DA-PEG-COOH
PLGA(40K)-PEG-COOH
PLGA(15K)-PEG-COOH
COOH-PEG-NH2.HCl
PLGA(1K)-PEG-COOH
COOH-PEG-CH2CH2COOtBu
PLGA(5K)-PEG-COOH
PLGA(1.8K)-PEG-COOH
PLGA(2K)-PEG-COOH
以上文章内容来源各类期刊或文献,如有侵权请联系我们删除!




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询