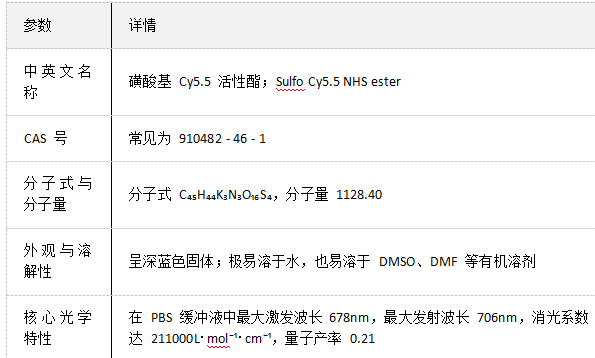
Sulfo Cy5.5 NHS ester 是磺化修饰的近红外荧光染料活性衍生物,因高水溶性和优良荧光特性,常用于生物分子标记等科研场景,以下是详细产品指南:
基础参数
核心优势
水溶性佳且生物相容性好:磺化修饰使其带负电,不仅能在水相反应体系直接使用,无需有机溶剂助溶,还能避免标记后引发蛋白质等生物分子疏水性聚集,保障标记产物稳定。
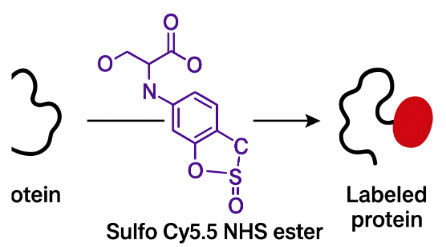
标记特异性强:NHS 活性酯基团可在温和条件下,与蛋白质、抗体、多肽等生物分子的伯氨基特异性反应形成稳定酰胺键,标记效率高。
适配近红外研究:发射波长处于肌体组织近红外窗口,生物组织穿透性强,且该波段背景荧光干扰低,光稳定性好,适合长时间成像观察。
适用场景常用于活体近红外成像、免疫荧光检测、流式细胞分析等。比如标记细胞膜蛋白实现受体内吞循环的实时追踪,修饰脂质体等纳米载体以观察药物摄取路径,也可用于细胞迁移分化追踪、多色流式细胞分选等科研场景。
使用与储存要点
使用:用 0.1M 磷酸盐缓冲液(pH8.3 - 8.5)作为反应体系,避免含氨基的 Tris 缓冲液;染料溶于无水 DMSO 后稀释使用,染料与目标分子摩尔比建议 4 - 12:1,反应在室温或 4℃下进行 30 - 60 分钟,后续用 1M Tris - HCl 终止反应,通过凝胶色谱等方式纯化产物。
储存:需在 - 20℃、干燥避光环境下保存,处于氮气等惰性气体环境;产品使用前需室温回温 20 分钟以上,避免频繁解冻,防止活性下降。
下面是Sulfo Cy5.5 NHS ester 标记蛋白的操作说明
Sulfo Cy5.5 NHS ester 是磺化修饰的近红外荧光染料,因高水溶性和特异性氨基标记能力,广泛用于蛋白荧光标记,以下为标准化操作流程及注意事项:
1、实验前准备
试剂与耗材
待标记蛋白(如抗体、白蛋白,需确保纯度>90%,浓度≥1mg/mL)
Sulfo Cy5.5 NHS ester 染料(-20℃避光保存,使用前室温回温)
缓冲液:0.1M 磷酸盐缓冲液(PBS,pH 8.3-8.5,不含氨基)、1M Tris-HCl(pH 7.4,用于终止反应)
耗材:避光离心管、移液枪及无酶吸头、凝胶过滤柱(如 PD-10)或超滤管(3kDa/10kDa)
预实验处理
对待标记蛋白进行缓冲液置换,去除原体系中的氨基(如 Tris、甘氨酸),可通过超滤或凝胶脱盐完成,确保蛋白悬浮于 0.1M PBS(pH8.3-8.5)中。
染料溶解:取适量 Sulfo Cy5.5 NHS ester,用无水 DMSO 配制成 10mM 母液(现配现用,避免长时间暴露于空气和光照)。
2、标记反应操作
摩尔比确定根据蛋白分子量和氨基数量,确定染料与蛋白的摩尔比,常规比例为4:1~12:1(小分子蛋白取低比例,抗体等大分子取 6:1~12:1,避免过度标记导致蛋白聚集)。
反应体系配制在避光离心管中加入蛋白溶液,缓慢滴加配制好的染料母液,轻轻颠倒混匀(避免剧烈震荡导致蛋白变性),确保染料均匀分散。
孵育反应将反应体系置于室温避光条件下孵育 30~60 分钟,若为对温度敏感的蛋白,可在 4℃条件下延长孵育至 2 小时,全程避免光照。
终止反应向体系中加入 1M Tris-HCl(终浓度 50mM),室温孵育 10 分钟,终止未反应的 NHS 活性酯基团。
3、标记产物纯化
凝胶过滤法采用 PD-10 凝胶过滤柱,用 PBS 平衡柱子后上样,收集第一洗脱峰(含标记蛋白),弃去后续游离染料峰,该方法适用于大部分蛋白的快速纯化。
超滤法选用对应截留分子量的超滤管,加入反应液后 12000rpm 离心,弃去滤液(含游离染料),向截留液中补充 PBS 重复离心 3 次,直至滤液无明显荧光,适用于高浓度蛋白的浓缩与纯化。
4、标记效率检测与储存
效率检测通过紫外分光光度计分别测定 280nm(蛋白特征吸收峰)和 678nm(染料特征吸收峰)的吸光度,根据公式计算染料 / 蛋白结合比(D/P),理想 D/P 值为 2~5,过高易导致蛋白聚合。
成品储存纯化后的标记蛋白可分装保存于 - 20℃或 - 80℃避光环境,短期使用可 4℃冷藏,避免反复冻融,使用前需复温至室温并轻轻混匀。
5、注意事项
反应体系 pH 需严格控制在 8.3-8.5,pH 过低会降低 NHS 酯活性,pH 过高易导致染料水解失效。
全程操作需避光,防止染料荧光淬灭,影响标记效果。
若蛋白含游离巯基等活性基团,需提前封闭,避免非特异性结合。




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询