双马来酰亚胺BODIPY荧光探针用于蛋白质特异性标记研究进展
用荧光探针对特定的靶蛋白(POI)进行标记已经成为研究蛋白表达、定位和转运的主要方式之一。然而,用于标记的荧光探针多数是“always-on”型的,这限制了其广泛应用。因此,设计合成”turn-on”型荧光探针用于特定蛋白的标记已成为一个研究热点。
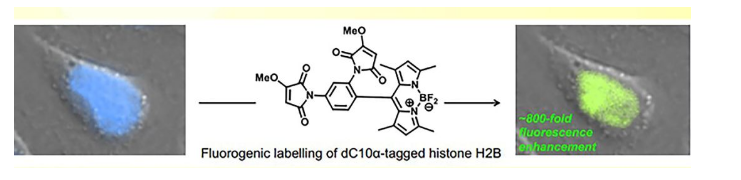
近日,加拿大渥太华大学的Jeffrey W. Keillor教授课题组设计合成了双马来酰亚胺荧光团4(又名YC23),该分子以氟硼二吡咯(BODIPY)为基本骨架,连接上双马来酰亚胺后,其光诱导电子转移(PET)的特性致使BODIPY发生荧光淬灭。只有当特定蛋白的巯基与马来酰亚胺发生加成反应后,BODIPY的荧光才能恢复(图1)。作者还将该分子应用于细胞裂解液和哺乳动物中特定蛋白的荧光标记。相关成果以“A green BODIPY-based, super-fluorogenic, protein-specific labelling agent”为题发表在Angew. Chem. Int. Ed.上(DOI: 10.1002/anie.201805482)。

作者选择了麦芽糖结合蛋白(MBP)作为测试蛋白,并将可遗传编码的肽标签dC10α标记在C末端得到MBP-dC10α。接着,作者对MBP-dC10α与YC23的反应进行了研究,结果表明:在与测试蛋白反应之前, YC23显示出可忽略的背景荧光(图2,x轴上的黑线)。随着MBP-dC10α加入量的增加,YC23的荧光强度**增加(图2)。

随后,作者对25 µM MBP-dC10α与25 µM YC23反应的动力学进行评估,探究其两次加成反应所拟合的函数模型,结果发现,其主要与二阶模型相匹配,速率常数为868±118 M-1min-1(图3)。

图3. 定量YC23与定量MBP-dC10α反应后的荧光强度随时间变化的拟合图
接下来,为了探究MBP-dC10α与YC23结合的选择性,作者在细菌裂解液中用YC23标记MBP-dC10α,并将温度升至95 ℃且维持15 min,再进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。结果显示,被标记的测试蛋白始终保持其明亮的荧光,甚至在变性条件下也能如此(图4B)。在细胞裂解液的复杂生物混合物中,低至10 μM的YC23足以可视地标记测试蛋白。图4A与4B的比较结果揭示了YC23标记的选择性,只有目标蛋白被明确标记并发出强烈的荧光。
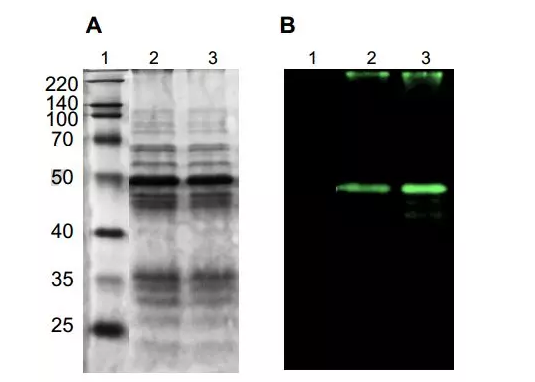
图4. MBP-dC10α与YC23结合的选择性分析
在细菌裂解液中探究了YC23的选择性后,作者又研究了其在哺乳动物细胞中的相关特性。作者选择了只存在于细胞核中的组蛋白H2B为特定蛋白,并将dC10α标记在它的C末端,随后,用能表达相关蛋白的质粒转染Hela细胞,将YC23与Hela细胞共同孵育。结果发现,YC23的荧光只存在于细胞核中,证明了其在哺乳动物细胞中具有较好的选择性(图5)。
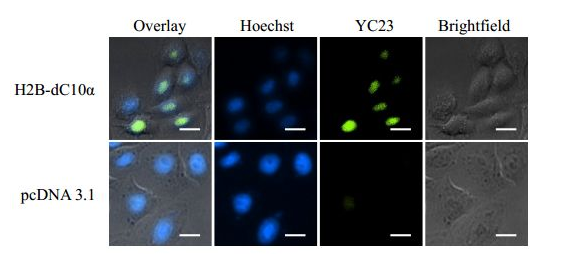
图5. Hela细胞的蛋白标记成像
总结:作者开发了一种用于蛋白标记的新型双马来酰亚胺BODIPY荧光探针,在细菌裂解液和哺乳动物细胞中均能标记特定的蛋白,且具有较高的选择性和稳定性,这对于探究蛋白的表达、定位和转运具有重要的应用价值。




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询