**的光动力**是利用基于各种过渡金属制备的光敏剂在光照下,耗竭线粒体中NADH从而破坏线粒体氧化还原电子传递链,进而引起氧化应激和细胞凋亡。然而在光动力**中,缺氧性**是令医生们**头疼的一种**,因为一般的光敏剂的电子转移都需要氧气的参与,使得这些光敏剂对缺氧性**细胞(hypoxic cancer cells)失去效果。除此之外,细胞内抗氧化系统解毒、诱导应激反应基因和P-糖蛋白介导**外排都会使**细胞产生抗药性,使得新型光敏剂的开发变得尤为重要。
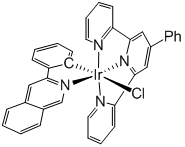
开发了一种新型的铱(III)光敏剂,在正常含氧和缺氧性**细胞中均具有良好的活性。化合物1结构如图所示,由一个C,N双齿配体(pq)和一个N,N,N三齿配体(ttpy)组成,Cl与C成反式,在特定波长光激发下,电子由pq配体激发到ttpy的π反键轨道**形成三重态激发态。验证了化合物1在有机溶剂、磷酸缓冲液以及血清中均具有良好的光/暗稳定性,随后通过循环电势法测得激发态的1具有高达1.22V的氧化电势(参比电极为甘汞电极),通过密度泛函分析验证了1与基态相比氧化还原的电子行为差异很大,说明1是一种强的激发态氧化剂。
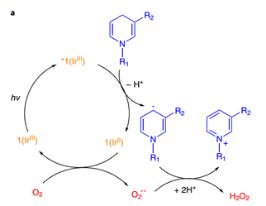
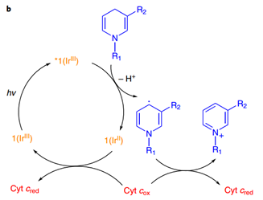
在体外正常含氧量条件下测试了1对NADH的氧化,光照条件下,1在重水/氘代甲醇体系以及磷酸缓冲液体系中,均能快速消耗NADH(30 min,95% NADH consumed)并生成过氧化氢(由过氧化物试纸监测),随后在体系中加入自由基捕获剂CYPMPO可以检测到CYPMPO-NAD,证明了1对NADH的氧化经历了单电子转移,通过密度泛函分析,他们计算出电子转移是通过NADH与1*中的pq或ttpy配体的π-π相互作用实现的。若在氮气氛围下,由于没有终端电子受体,光反应不能发生。线粒体中的细胞色素C(cyt c)可以作为电子受体[cyt c (Fe2+/Fe3+)],在不含氧且加入cyt c的条件下,1可以在光照下顺利氧化NADH。
在完成细胞外实验之后,又测试了化合物1对一系列**细胞和几种正常细胞(MRC-5, LO2)的杀伤效果。在无光条件下,无论是含氧还是缺氧,1对所有细胞均只有低毒性,而在光照条件下,无论含氧还是缺氧,1的细胞毒性均大大增加,具有较高的光细胞毒指数(dark IC50/lightIC50),在缺氧条件下,临床前药5-ALA无效的几种**细胞[NCI-H460 (lung),HeLa (cervix), Hep G2 (liver), SGC-7901 (gastric)],均受到1的**,而且这种**效果不受ROS捕获剂的影响。在A549实体瘤模型中,1也表现出良好的光细胞毒指(dark/light:12.6/1.3μM),而同样的缺氧条件下,5-ALA和顺铂几乎没有光毒性。
来源:本文来源网络,版权归相关权利人所有,如侵权,请联系删除
wyf 12.04




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询