同位素示踪技术的样本制备及其检测
样本制备
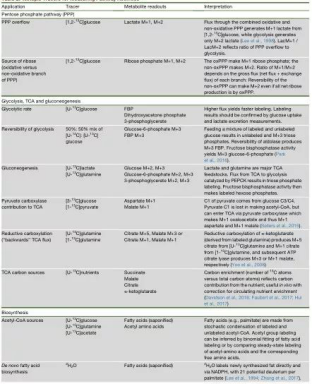
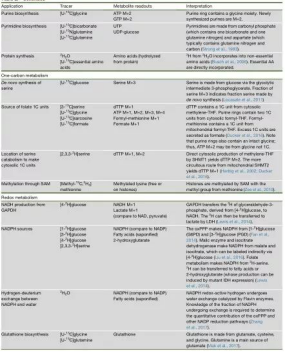
理想的实验结果始于精心的实验设计。对于同位素示踪实验,先,稳定同位素的选择很重要,根据不同研究目的需选择不同的稳定同位素示踪剂,以下图表中列出的同位素示踪剂可供大家根据各自需求进行选择。此外,实验中要控制好各种影响因素,比如体内实验要注意饲养、空腹、饮食结构等方面;细胞培养则要注意培养基的选择及培养基的更换时间等;以及同位素示踪剂的浓度、时间等等。进行同位素示踪实验时,一定要避免代谢物之间的交叉干扰,如特殊营养培养基的更换,其余营养物质的浓度要注意是否保持一致。标记感兴趣的通路代谢物时,需要注意研究较终目的是获取动态的物质浓度还是稳态时的物质浓度。一般而言,细胞培养时,糖降解过程达到稳态需要10min,三羧酸循环(TCA)需要超过2h,到达核苷酸则需要24h以上,但不同种类的细胞代谢时间不同。
有时也需要连续收集样本去获取糖降解的动态结果(如10s为一个时间循环),而TCA可设定在15min,30min,60min,120min分别收集样本。其次,是关于代谢物的收集方法。不同的生物样本其要求不同,尤其是很多瞬间即逝的重要代谢物,及时的终止代谢过程、获得准确代谢物信息是实验的关键。常规方法包括冷冻或者酶变性法。细胞实验经常采用加入低温有机溶剂降低代谢活性并促使酶的活性永久变性,而组织样本可以先-80℃冻存再进行低温有机溶剂提取。如果低温有机溶剂不能立即终止酶活性应该怎么解决?如NADPH,ATP等这些高能量物质即使缓和降解仍然会引起NADP、ADP、AMP明显增加。对于这类物质,可以采用添加酸的有机溶剂加速酶变性,比如加入0.1 M甲酸的混合溶剂(乙腈:甲醇:水=40:40:20)。较后,要保证样本收集的一致性。
样本检测
样本收集后,接下来的挑战便是尽可能保证检测结果的准确性。分析技术主要是NMR及MS技术,NMR不仅可以确定化合物上被标记的碳的数量(isotopomer),同时也可确定稳定同位素所标记上的位置(isotopologue),从而追踪某一代谢物的不同通路来源,但对于混合物分析,NMR解谱相对难度大。如今,越来越多的研究者选择用MS来检测,因为其具有更出色的灵敏度、分辨率及特异性等性能。尤其是气相色谱质谱联用技术(GC-MS),可以利用硬电离(EI)和软电离(CI)得到不同的代谢物的碎片信息,从而判断同位素标记的不同位置。
同时,色谱分离对于同位素示踪研究尤为重要。色谱分离技术不仅可以将质荷比接近的物质分开,防止其他物质对同位素丰度的影响,同时也可以分离来自不同代谢通路的同分异构体,从而得到准确的代谢通路信息。常见代谢组学平台分为气相色谱质谱联用(GC-MS)和液相色谱质谱联用(LC-MS)。GC-MS利用其30米,甚至60米的长色谱柱,通常能较好的分离不同的代谢物。LC-MS通过采用不同的色谱柱可以检测不同种类代谢物,如反相色谱柱C18适用于检测极性代谢物和脂质,HILIC色谱柱可检测各类强极性物质。
来源:本文备份来源网络,版权归相关权利人所有,如侵权,请联系删除.




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询