量子金纳米团簇(AuNCs)通常由自顶向下或自底向上的方法合成。在这两种方法中,由于它们对金有很强的亲和力,含硫醇的配体,包括小分子、聚合物和蛋白质,已被广泛地用作覆盖剂来生产AuNCs。自顶向下的刻蚀方法可以制备单分散纳米团簇,但刻蚀步骤繁琐且涉及有毒表面活性剂和溶剂。相反,在自下而上的方法中,AuNCs是通过在含硫醇配体存在下还原金前体而合成的,这可以在水环境中进行。这种水路径不需要可能导致下游细胞毒性的化学物质,已经成为制造用于生物应用的AuNCs的选择方法。但是,这种合成路线导致AuNCs具有更宽的发射光谱和较低的量子产额(QY)(1%),因为它们具有较高的多分散性。利用黄原酸盐的金属离子结合特性,用一种模板辅助合成方法来生产单分散、稳定、荧光的AuNCs。通过使用末端有黄原酸盐的聚(环亚氨基醚) (PCIEs),证明Au3+和黄原酸基团之间会发生相互作用,形成静电稳定的核壳中间纳米复合物,这对模板和生产**的**PCIE-AuNCs至关重要。通过将金前体(HAuCl4·3H2O)溶液加入到比PEtOx或PEtOz溶液多3倍摩尔量的溶液中,然后用硼氢化钠(NaBH4)还原得到AuNCs(图1)。
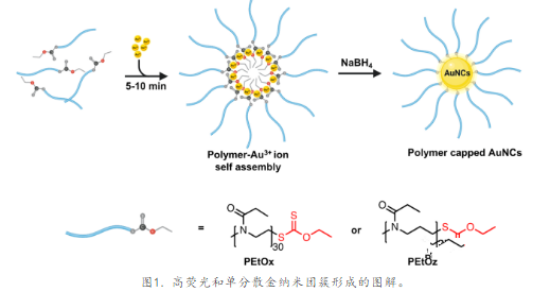
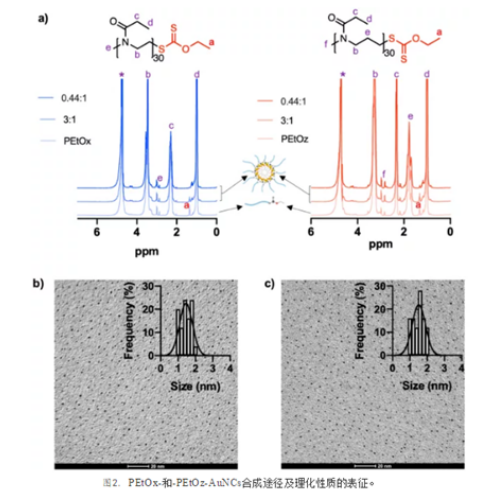
加入Au3+溶液后,溶液变为棕黄色。当Au3+和含硫醇的自由配体首次混合时,观察到颜色消失,形成了可溶性无色的Au(I)-硫醇复合物。当Au3+溶液加入到对照聚合物中,没有观察到颜色变化。这表明黄褐色可能是由于形成了由Au3+和黄原酸盐组成的核壳纳米结构,具有静电稳定的核,而这是硫代配体无法得到的。黄原酸酯在金属离子存在下化学稳定,并通过静电相互作用结合。因此,在加入Au3+后,黄原酸基团的结构没有变化。质子核磁共振(1H NMR)光谱也监测了这种相互作用(图2a),其中PEtOx和PEtOz聚合物与D2O中不同数量的Au3+混合。随着Au3+浓度的增加,PEtOx和PEtOz黄原酸基在δ ≈ 1.3 ppm处的甲基峰强度降低(图2a)。聚合物由ω-黄原酸端基与Au3+相互作用引发的自组装可以解释在1H NMR中观察到的甲基峰信号的降低,这是由于D2O中黄原酸基的较差的溶剂化和分子流动性造成的。透射电子显微镜(TEM)图像显示,PEtOx-和PEtOz-AuNCs均为单分散的,核心直径约为2 nm (图2b,c)。由DLS计算的平均直径显示,由于AuNCs的水化聚合物壳可能比TEM图像更大(图2b,c)。
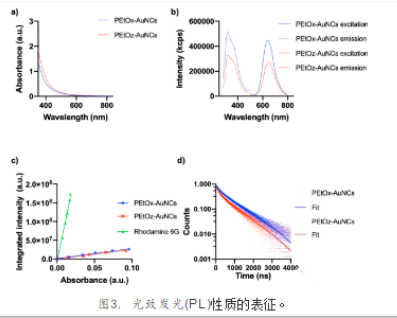
即使在高浓度(1.8 mg Au mL -1)下,在λ= 510-560 nm附近的紫外可见光谱也没有出现SPR峰(图3a),这表明没有形成更大的金纳米颗粒。PEtOx-AuNCs的激发值和发射值分别为λex = 312 nm和λem = 641 nm, PEtOz-AuNCs的激发值和发射值分别为λex = 312 nm和λem = 645 nm(图3b)。以乙醇中罗丹明6G为参比物,我们发现PEtOx-和PEtOz-AuNCs的QYs分别为4.8%和4.3%(图3c),与通过蛋白质模板制备的PEtOx-和PEtOz-AuNCs的QYs相当。时间分辨PL分析表明,PEtOx-和PEtOz-AuNCs有两种组分:主组分(90%),荧光寿命分别为844和722 ns;次要组分(10%),荧光寿命分别为185和139 ns(图3d)。金配体之间的电荷转移可能导致寿命的延长,而单重态激发电子可能导致寿命的缩短。与PEtOz-AuNCs相比,PEtOx-AuNCs的荧光衰减时间较慢,这主要是由于无辐射衰减的减少和略高的QY所致。PCIE-AuNCs的荧光半衰期可能是有益的,因为它可以通过时间门控成像克服组织的自发荧光,其中组织的自发荧光半衰期在1 ~ 10 ns之间,与大多数有机荧光团重叠。因此,与有机荧光团相比,PCIE-AuNCs显示出良好的光学特性,使其成为**的成像工具。
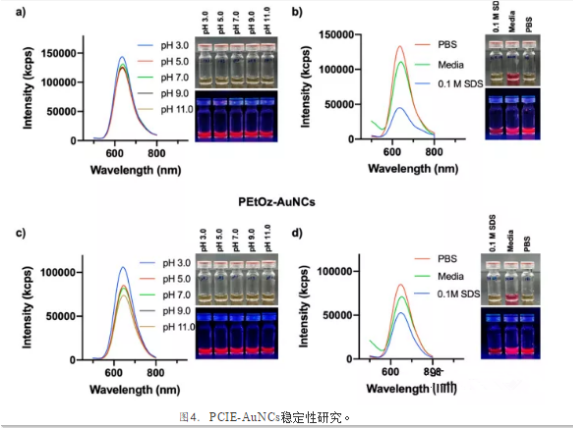
然后,测试了不同pH值(3,5,7,9和11)、PBS (10 mM, pH 7.4)、完全培养基和0.1 M十二烷基硫酸钠(SDS)下表面涂层的稳定性(图4)。在pH范围、PBS和完全培养基中,两种PCIE-AuNCs都表现出良好的荧光强度,在pH为3时PEtOx-和PEtOz-AuNCs的荧光略有增加(图4a,c)。与0.1 M SDS孵育的PEtOx-和PEtOzAuNCs的荧光强度分别降低了65%和35%(图4b,d)。
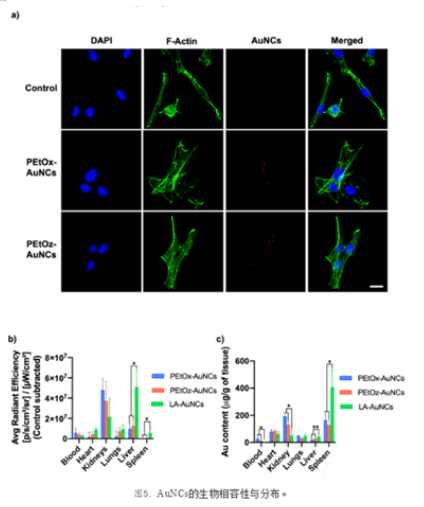
此外,通过共聚焦激光扫描显微镜(CLSM)研究了细胞对PEtOx-或PEtOz-AuNCs的摄取。Z-stack图像证实PCIE-AuNCs在24小时内被细胞内化,因为AuNC荧光与F-actin和细胞核在同一平面上观察到(图5a)。为了评估PCIE-AuNCs在体内应用的适用性,静脉给药24小时后,研究了AuNCs在健康BALB/c小鼠体内的生物分布(图5b)。通过评估AuNCs在体外主要器官的内在荧光信号,我们能够确定它们的命运取决于表面配体。通过减去背景信号来去除自身荧光。与LA-AuNCs相比,PCIE-AuNCs在肝脏和脾脏中的积累**降低。24 h后采集的肾脏和心脏血样的荧光信号高于LA-AuNCs记录的荧光信号。这些发现通过ICPOES定量Au/g组织的数量得到了证实(图5c)。与LA-AuNCs相比,PCIE-AuNCs在肝脏和脾脏中的蓄积**降低,而在肾脏和血液中的蓄积**升高,提示循环时间更长,肾脏有潜在的清除作用。LA-AuNCs的高白蛋白结合亲和力可能是其生物分布差异的原因。研究表明,对白蛋白有强亲和力的纳米颗粒容易扰乱蛋白质结构,导致纳米颗粒在肝脏和脾脏内积聚。这可以**减少血液中循环的LA-AuNCs数量(图5c),从而减少LA-AuNCs用于肾脏清除的可用性。
Au44(SCH3)28手性金纳米团簇
刀豆求蛋白修饰金纳米团簇
半胱氨酸修饰金纳米团簇Au25Cys18
DHLA-AuNCs二氢硫辛酸保护金纳米团簇
巯基琥珀酸保护金纳米团簇
聚(N-乙烯基咪唑)配体金纳米团簇
树枝状聚合物PAMAM修饰金纳米团簇
聚(N-乙烯基-2-吡咯烷酮)修饰金纳米团簇PVP-AuNCs
胰岛素修饰红色荧光金纳米团簇
超高荧光量子产率近红外金纳米团簇
AIE效应的金纳米团簇
聚集诱导发光效应金纳米团簇
不同金数量的纳米金团簇
Au144(SR)60金纳米团簇
环糊精修饰金纳米团簇(单金属)
卟啉修饰金纳米团簇
碳纳米管负载金纳米团簇
Au15(SR)13小尺寸金纳米团簇
Cd1Au14(StBu)12合金纳米团簇
金刚烷硫醇保护的Au40(S-Adm)22纳米团簇
γ-环糊精-金属有机框架(γ-CD-MOF)
Au25(SR)18不同配体不同数量金纳米团簇
二氧化硅-BPEI-金纳米团簇
Au38(SR)24金团簇
单分子层保护的金纳米团簇(Au-MPCs)
Au36(SR)24金纳簇
zzj 2021.2.25




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询