乙型肝炎病毒(HBV)的一个特点是前C/C区编码的构成病毒核衣壳的core蛋白和前C蛋白(precore)存在高度的氨基酸序列同源性,后者经过加工、成熟为分泌型的HBeAg。该研究使用T细胞受体(TCR)转基因(Tg)、TCR×HBc / HBeAg双转基因和三联转基因实验组,证明在该系统中HBeAg引起T细胞耐受,而HBcAg不引起耐受。
TCR×HBc 双转基因小鼠在幼年时就会发生血清转换,抗-HBc IgG抗体呈阳性;但TCR×HBc×HBe三联转基因小鼠血清中存在的HBeAg会阻止抗-HBc血清转换。HBeAg通过引起HBc/HBeAg特异性T细胞耐受而发挥免疫调节作用。结果表明,HBV之所以保留了核蛋白的分泌形式,是因为它起着T细胞耐受原的作用,调节对胞内核衣壳的免疫应答。这种由HBeAg介导的免疫调节可能会导致围生期感染的慢性化,并防止成人感染HBV后严重肝损伤的发生。
乙型肝炎病毒e抗原(precore或HBeAg)以单体的形式分泌到血清中,而核心抗原(core 蛋白或HBcAg)是包裹病毒DNA和聚合酶的核衣壳的构成成分,参与病毒颗粒组装。由于氨基酸同源性较高,这两种抗原形式在T细胞反应水平上具有交叉反应性,但在抗体识别水平上却不具有交叉反应性。自HBeAg被发现起,因为它并非病毒感染、复制或组装所必需,其功能广受猜测。该文作者曾基于小鼠实验提出HBeAg发挥免疫调节的作用,但相关问题仍有待厘清。Precore、core两种形式的核蛋白共存于HBV自然感染过程中,并对HBcAg和HBeAg的免疫应答似乎是独立调节的。例如,HBcAg可以表现为T细胞非依赖性抗原,而对HBeAg的免疫应答则是严格的T细胞依赖性的;HBcAg优先诱导Th1细胞,而HBeAg优先诱导Th0/Th2细胞。HBcAg和HBeAg主要的抗原提呈细胞也不同。
HBeAg的T细胞耐受性明显更高。T细胞对HBeAg的耐受是克隆性的,并且至少可以通过三种机制介导:克隆清除(clonal deletion)、克隆无能(clonal anergy)和克隆忽视(clonal ignorance)。血清HBeAg可能会清除亲和力高的T细胞,而中等亲和力的HBeAg特异性T细胞可能不会被清除,但仍可以通过克隆无能引发免疫耐受。因此,即使是亲和力较低的HBeAg特异性T细胞也容易出现HBeAg诱导的耐受。
既往研究以T细胞受体转基因(TCR Tg)小鼠谱系为代表,主要集中在单一的对HBc / HBeAg具有中等亲和力的特异性T细胞克隆群。而在该研究中,使用表达HBcAg和/或HBeAg的转基因小鼠繁育TCR-Tg小鼠,以产生7/16-5×HBc、7/16-5×HBe双转基因和7/16-5×HBc×HBe三联转基因实验组小鼠,用来检查内源性HBeAg和HBcAg在单独和联合时对特定的HBc/HBeAg特异性T细胞亚群的影响。结果表明,血清HBeAg可以作为**的T细胞耐受原,在HBcAg是强免疫原的转基因系统中下调对HBcAg的免疫应答。
一、血清HBeAg**自发的抗-HBc IgG抗体血清转换
作为慢性HBV感染的模型,TCR×HBc/HBeAg 转基因小鼠被用于探究持续的抗原暴露对T细胞的影响。7/16-5 Tg TCR (Vβ11⁺-Vα5⁺)对 HBc/HBeAgs的120–140残基特异,受I-Aᵇ MHC II类分子限制, 表达于53%的CD4⁺ T 细胞。在该研究中,六只表达HBc/HBeAg特异性7/16-5 TCR和HBcAg(7/16-5×HBc)的双转基因小鼠在4至6周龄时全部自发血清转换为抗-HBc IgG抗体阳性(图1),产生了所有IgG亚型的抗-HBc抗体;丰富程度从高到低依次为IgG2b、IgG2a、IgG1和IgG3。在7/16-5×HBc 双转基因小鼠中自发的抗-HBc血清转换表明,HBcAg没有耐受性,而是在体内充当7/16-5 T细胞的免疫原。由于颗粒状HBcAg在B细胞水平上具有很高的免疫原性,因此从肝细胞中“泄漏”出来的少量的这种胞内抗原足以引起自发的抗-HBc血清转换。
相比之下,在7/16-5×HBe双转基因小鼠中,不会引起自发的HBeAg向抗-HBe (IgG抗体)血清转换,表明7/16-5 T细胞可以耐受血清HBeAg。通过繁殖能够同时表达7/16-5 TCR、HBcAg和HBeAg的三联转基因小鼠,以确定在对HBcAg的免疫原性应答和对HBeAg的耐受性应答之间,谁会占据主导地位。在六只7/16-5×HBc×HBe 三联转基因小鼠中,血清中的HBeAg(4-10μg/mL)阻止了其中两只的自发抗-HBc IgG抗体血清转换,并在其余四只小鼠中****抗-HBc IgG抗体的产生(图1)。三联转基因小鼠产生的抗-HBc不但抗体低水平,并且抗体出现时间延迟、 IgG亚型有限。据此可见,血清HBeAg是作为一种免疫调节蛋白在体内下调对HBcAg的体液反应。
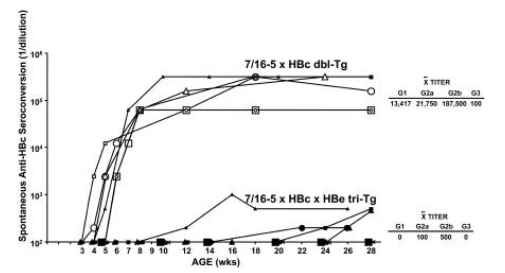
图1. 血清HBeAg**抗-HBc自发血清转换。每组6只7/16-5×HBc双(dbl)转基因小鼠和7/16-5×HBc×HBe三联(tri)转基因小鼠,3至28周龄之间取血,收集血清,并通过ELISA测定抗-HBc抗体的总IgG和IgG亚型。通过终点稀释血清定量检测抗-HBc抗体。符号代表单独的小鼠。7/16-5 Tg TCR(Vβ11⁺-Vα5⁺)对HBc / HBeAgs的120-140残基具有特异性,受IA ᵇ MHC II类分子限制,并在53%的CD4⁺ T细胞上表达。对照HBcAg单转基因小鼠未自发产生抗-HBc抗体。
分离7/16-5×HBc、7/16-5×HBe 双转基因和7/16-5×HBc×HBe三联转基因小鼠的脾细胞,在存在HBcAg或HBeAg的条件下进行体外培养。在脾脏原代培养中,7/16-5×HBc脾细胞产生大量抗-HBc IgG抗体,而7/16-5×HBe双转基因脾细胞未产生抗-HBe IgG抗体,且三联转基因脾细胞也未产生抗-HBe IgG抗体(图2 A)。体外脾脏原代培养物中IgG抗体的产生与体内抗-HBc/e IgG抗体的产生平行(图1)。体外7/16-5×HBe双转基因脾细胞未产生抗-HBe IgG抗体,证明在体内检测不到自发抗-HBe IgG抗体不是由于免疫复合物或血清HBeAg对抗-HBe的掩盖。
接着检测脾脏培养上清液中是否有抗-HBc IgM抗体的产生。如图2 B所示,所有7/16-5 TCR⁺ 双转基因和三联转基因小鼠的脾细胞在与HBcAg原代培养后均产生抗-HBc IgM抗体(7/16-5 TCR单转基因脾细胞在与HBcAg原代培养后也产生了抗-HBc IgM抗体),值得注意的是7/16-5×HBc×HBe三联转基因小鼠的脾细胞在体外不产生抗-HBc IgG抗体,而会产生高水平的抗-HBc IgM抗体。与7/16-5×HBc双转基因脾细胞相比,7/16-5×HBc×HBe三联转基因脾细胞中抗-HBc IgG抗体和抗-HBc IgM抗体的生成分别被**和增强。由此可以推断,在HBeAg存在时,在产生的抗体从抗-HBc IgM转变为IgG的过程中,Th的重要性降低了;并且,在HBeAg存在的同时又有Th功能不足时,HBcAg一般会诱导产生更多的抗-HBc IgM抗体。这一发现可能与在慢性HBV患者中经常观察到的抗-HBc IgM抗体的周期性复发有关。
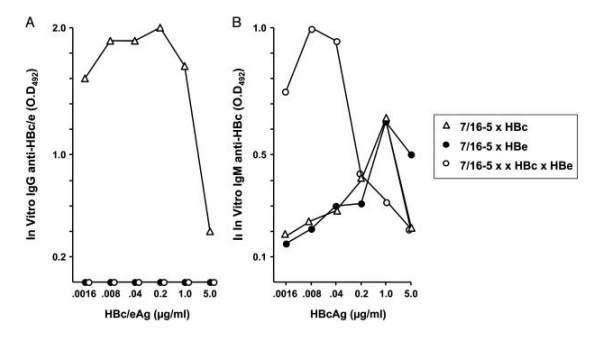
图2. 7/16-5 TCR⁺ 双转基因和三联转基因小鼠脾细胞体外抗-HBc/e抗体的产生。向来自7/16-5×HBc和7/16-5×HBe双转基因小鼠以及7/16-5×HBc×HBe三联转基因小鼠的脾细胞加入不同浓度的重组HBcAg或HBeAg,培养5天。收集培养物上清液,并通过ELISA确定IgG(A)和IgM(B)抗-HBc / e抗体的产生。分析未稀释的培养物上清液,并将结果表示为OD₄₉₂ 值,减去从无抗原的培养基对照孔中获得的背景OD₄₉₂ 值进行校正。符号代表单独的小鼠,并且结果代表每组至少五只小鼠。
之前对HBeAg下调抗-HBc血清转换的简单解释是:由于氨基酸序列的高度同源性,血清HBeAg可能在检测中掩盖了抗-HBc抗体。然而,实际上将HBeAg-Tg小鼠的血清添加到抗-HBc抗体的稀释液中不会影响抗-HBc抗体的检测。对7/16-5×HBc×HBe三联转基因小鼠抗-HBc产生减少的**个可能解释是:表达两种转基因的小鼠肝脏中的HBcAg含量较低。尽管HBc/HBe双转基因小鼠细胞内HBcAg的表达往往比HBc单转基因小鼠约少一半,但抗-HBc血清转换与肝脏中HBcAg含量之间没有相关性,表明低浓度HBcAg浓度(0.2-2.0μg/ mg肝蛋白)并不是限制抗-HBc抗体产生的原因。
二、血清HBeAg可激发7/16-5 TCR-Tg T细胞耐受
由于7/16-5 TCR-Tg小鼠中HBc/HBeAg特异性T细胞的比例较高(占53%的CD4+T细胞),在体外用HBc/HBeAgs 培养未接触抗原的脾脏T细胞会产生大量的IL-2和IFN-γ(图3)。p120-140(对应于HBcAg的120-140残基的合成肽)能被7/16-5 T细胞识别。分别在HBcAg、HBeAg或p120-140条件下,7/16-5×HBc双转基因小鼠的脾T细胞产生的IL-2和IFN-γ与TCR单转基因小鼠T细胞的产量相当。T细胞对HBcAg缺乏耐受,与7/16-5×HBc双转基因小鼠体内抗-HBc IgG抗体的自发产生相符。相比之下,7/16-5×HBe双转基因小鼠的脾T细胞在T细胞水平上具有**的耐受性,并且在使用HBc/HBeAg进行体外培养的过程中产生的T细胞细胞因子较少(图3)。除了细胞因子产生减少,相比于来自TCR单转基因小鼠的T细胞,来自7/16-5×HBe双转基因小鼠的T细胞还表现出HBc / HBeAg特异性增殖缺陷。此外,血清HBeAg在7/16-5×HBe双转基因小鼠中引起的T细胞耐受不是由于胸腺或脾脏中7/16-5 T细胞的克隆清除,而是一种无能。测定7/16-5×HBc×HBe三联转基因小鼠中T细胞产生的细胞因子,可以证明血清HBeAg诱导了7/16-5 T细胞对HBc/HBeAg的特异性耐受,这与在7/16-5×HBe双转基因小鼠中观察到的特异性耐受程度相同(图3)。
因此,分泌的HBeAg(而非细胞内HBcAg)能引起7/16-5 T细胞的耐受/无能,血清HBeAg在T细胞水平通过这种方式下调7/16-5×HBc×HBe三联转基因小鼠的自发抗-HBc血清转换。此外,体内激活的7/16-5 T细胞介导7/16-5×HBc双转基因小鼠的肝损伤,但是在7/16-5×HBc×HBe 三联转基因小鼠中存在的血清HBeAg可**减轻肝损伤。因此,血清HBeAg的免疫调节作用不仅局限于**抗-HBc抗体的产生,还影响HBcAg特异性CD4⁺ T细胞介导的肝损伤。这些结果表明,分泌形式的核蛋白在患者体内的功能是作为**的T细胞耐受原,下调宿主对细胞内表达的HBcAg的免疫应答。
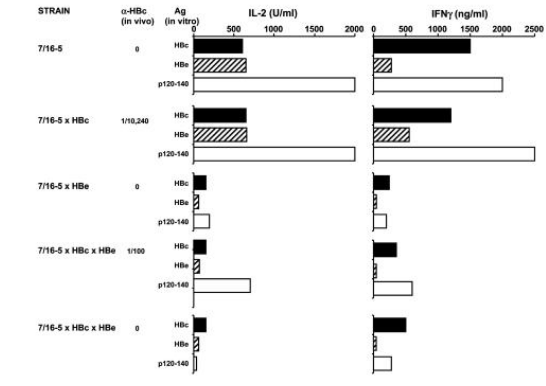
图3. 血清HBeAg 在7/16-5 T细胞中引起体内耐受/无能。用HBc/HBeAgs(1.0μg/mL)培养7/16-5 TCR单转基因、7/16-5×HBc双转基因、7/16-5×HBe双转基因或三联转基因小鼠的未接触抗原的脾细胞(5×10⁶ /mL),分别在第2天和第4天检测培养上清液中产生的IL-2和IFN-γ细胞因子。每只小鼠体内抗-HBc IgG抗体血清滴度均已标示。数据来自单只小鼠,至少代表三次独立实验。
三、在7/16-5 TCR-Tg T细胞中诱导T细胞耐受/无能取决于激活状态并且可逆
为了评估另一种模型中血清HBeAg调节对HBcAg的免疫应答的能力,将7/16-5供体T细胞分别过继转移至HBcAg-Tg、HBeAg-Tg或HBc/HBe双转基因受体小鼠的转移实验。将初始脾细胞(30×10⁶)从7/16-5 TCR-Tg供体小鼠过继转移至清除了T细胞的HBeAg-Tg受体小鼠中,未产生抗-HBe抗体,表明在这种情况下血清HBeAg对7/16-5 T细胞没有免疫原性(图4);将数量相同的初始7/16-5供体脾细胞过继转移至清除T细胞的HBcAg-Tg受体小鼠中,在2-4周内受体小鼠产生高滴度的(1:100000终点稀释)、包含所有IgG亚型的抗-HBc抗体;而将初始的7/16-5供体脾细胞过继转移到HBc/HBeAg双转基因受体小鼠中后,仅有很少的抗-HBc抗体产生,为HBcAg单转基因受体小鼠产生量的0.2%(图4)。由此可见,除了非免疫原性外,血清HBeAg还可以使转移的7/16-5 T细胞耐受,不再介导HBc/HBeAg-Tg受体小鼠的抗-HBc血清转换。该结果与前面观察到的7/16-5×HBc×HBe三联转基因小鼠中没有自发的抗-HBc血清转换得结果相符(图1)。在过继转移7/16-5 T细胞后,HBc/HBe双转基因受体小鼠中低水平的血清HBeAg(10 ng/mL)也会减少抗-HBc抗体的产生(图4)。血清HBeAg在T细胞水平上**抗-HBc血清转换,因为转移的7/16-5 T细胞未能在HBe单转基因和HBc/HBe双转基因受体小鼠脾脏培养物中产生抗原特异性IL-2,而HBc单转基因受体脾培养物中细胞因子的产生活跃。同样,仅在HBc单转基因受体脾培养物中检测到了抗-HBc/e IgG抗体的产生。而所有Tg受体小鼠脾脏培养物均产生抗-HBc IgM抗体,且HBc×HBe双转基因受体脾细胞中的抗-HBc IgM抗体产生增加。这一结果与7/16-5×HBc×HBe三联转基因小鼠脾细胞体外产生的抗-HBc IgM抗体水平升高相一致。
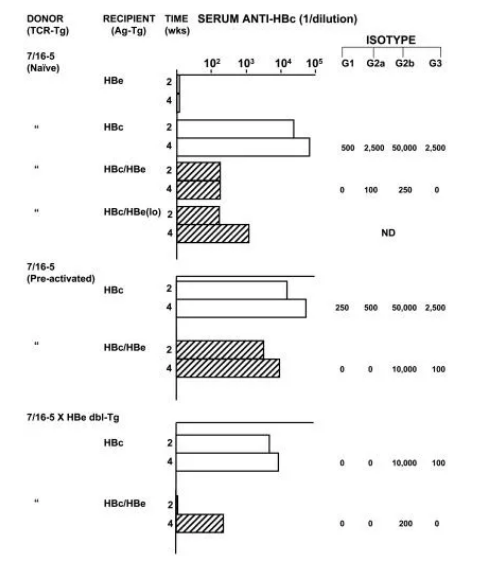
图4. 诱导7/16-5 T细胞耐受/无能取决于T细胞的活化状态,并且可逆。将来自7/16-5 TCR Tg小鼠的,含有约3×10⁶ TCR⁺ CD4⁺ T细胞的供体脾细胞(30×10⁶)过继转移到CD4 / CD8清除的HBcAg或HBeAg单转基因,和HBc/ HBeAg双转基因受体小鼠中(每组三只受体小鼠)。供体脾细胞包含初始7/16-5 T细胞、使用p120-140(1.0μg/mL持续3天)体外预激活的7/16-5 T细胞,或从7/16-5×HBe双转基因小鼠提取的7/16-5 T细胞。转移后第2和第4周,给受体小鼠取血,并通过ELISA测定抗-HBc抗体的总IgG和IgG亚型。在用初始7/16-5 T细胞(第1组)过继转移的HBeAg-Tg受体小鼠中,测定了抗-HBe IgG抗体。对每组三只受体小鼠的合并血清进行总抗-HBc IgG抗体测定和IgG分型。
实验通过转移天然7/16-5供体脾细胞进行。将预激活的7/16-5供体脾细胞(即用p120-140培养)转移到HBc/e双转基因受体中,与转移初始脾细胞相比,体内产生的抗-HBc抗体增加到50倍(1:10,000滴度)(图4)。因此,活化的7/16-5 T细胞对受体中血清HBeAg诱导的耐受较不敏感。为了确定7/16-5×HBe双转基因小鼠中7/16-5 T细胞的无能状态是否可逆,将双转基因供体中提取的脾细胞也转移到HBcAg或HBc/HBe双转基因受体中。转移到HBc / HBe 双转基因小鼠体内几乎不会产生抗-HBc抗体,而转移到HBc单转基因小鼠中则会导致抗-HBc抗体的产生(1:10,000滴度)(图4)。转移到HBc-Tg受体中的无能的7/16-5供体T细胞诱导产生的抗-HBc抗体水平是初始7/16-5供体T细胞对应水平的10%,特定的IgG亚型水平仍为阳性,表明体内暴露于血清HBeAg的7/16-5 T细胞的耐受状态至少可在没有耐受原(即HBeAg)的情况下逆转或发生改变。在该系统中,HBeAg介导的T细胞耐受是非清除性的,并且在没有耐受原(HBeAg)的情况下是可逆的,因此将其描述为体内无能或适应性耐受。
西安齐岳生物供应抗体种属∶兔抗单克隆抗体,鼠抗单壳隆抗体。兔抗多壳隆抗体。抗体的浓度为1mglml。抗体及相关标记抗体:HRP标记抗体,Biotin标记抗体,Gold标记抗体,RBITC标记抗体,AP标记抗体,FITC标记抗体,Cy3标记抗体,Cy5标记抗体,Cy5.5标记抗体,Cy7标记抗体,PE标记抗体,PE-Cy3标记抗体,PE-Cy5标记抗体,PE-Cy5.5标记抗体,PE-Cy7标记抗体,APC标记抗体,AlexaFluor 350标记抗体,Alexa Fluor 488标记抗体,Alexa Fluor 555标记抗体,AlexaFluor647标记抗体抗体的交叉反应︰人,小鼠,大鼠,鸡,狗,猪,羊,牛,兔.....抗体的应用:可以用于做石蜡切片免疫组化,冰冻切片兔疫组化,Elisa , wB,免疫荧光等实验。
相关产品
人聚集蛋白(Agrin)elisa试剂盒
小鼠Ⅰ型前胶原羧基端肽(PⅠCP)elisa试剂盒
大鼠全段甲状旁腺素(i-PTH)elisa试剂盒
兔热休克蛋白70(HSP-70)elisa试剂盒
人激活素A受体Ⅰ(ACVR1) elisa试剂盒
人组织型纤溶酶原激活因子(tPA) elisa试剂盒
人α乳清蛋白(α-La)elisa试剂盒
小鼠胶质细胞系来源的神经营养因子(GDNF)elisa试剂盒
大鼠磷酸肌醇3激酶(PI3K)elisa试剂盒
兔子γ干扰素(IFN-γ)elisa试剂盒
人膜突蛋白(MSN) elisa试剂盒
碳反应蛋白C-Reactive Protein
c 反应蛋白 人
鸡体内产生的抗C反应蛋白抗体
山羊产生的抗C反应蛋白抗体(全抗血清)
兔产生抗C反应蛋白抗体
抗C反应蛋白抗体,克隆2A8.1
抗C反应蛋白兔pAb
c反应蛋白,人血清,高纯度
C反应蛋白,人,重组,大肠杆菌
人 C 反应蛋白 ELISA 试剂盒
SILu ? 蛋白 CRP C 反应蛋白 人
单克隆抗 C 反应蛋白 小鼠抗
大鼠CRP/C反应蛋白酶联免疫试剂盒
SILu?Lite CRPC反应蛋白人类
c-反应性/CRP人
小鼠产生单克隆抗CRP抗体
小鼠产生单克隆抗CRP抗体
兔体内产生抗CRP抗体
兔体内产生抗CRP抗体
兔体内产生的抗VAC14抗体
小鼠产生抗单核细胞趋化蛋白单克隆抗体
抗FOXM1抗体
人血清
重组人丙型肝炎病毒非结构蛋白5A反式激活蛋白
羧肽酶N1(CPN1)重组蛋白
羧肽酶O(CPO)重组蛋白
细胞维甲酸结合蛋白2(CRABP2)重组蛋白
复合素2(CPLX2)重组蛋白
半胱氨酸甘氨酸丰富蛋白1(CSRP1)重组蛋白
半胱氨酸丰富分泌蛋白3(CRISP3)重组蛋白
晶状体蛋白λ1(CRYλ1)重组蛋白
羧基端结合蛋白2(CTBP2)重组蛋白
肉毒碱棕榈酰基转移酶1A(CPT1A)重组蛋白
肉毒碱棕榈酰基转移酶1B(CPT1B)重组蛋白
乙型肝炎病毒前-S1蛋白反式激活蛋白
乙型肝炎e抗原反式激活蛋白(HBeAgTP)
酸性反式激活蛋白
重组葡萄球菌蛋白a
PAPI改性大豆蛋白复合材料
磷酸盐/酵母蛋白纳米复合材料
FITC标记的丙型肝炎病毒非结构蛋白5A反式激活蛋白9抗体
PE-Cy5标记的丙型肝炎病毒非结构蛋白5A反式激活蛋白9抗体
HRP标记抗体,丙型肝炎病毒非结构蛋白5A反式激活蛋白9抗体
CIITA II型反式激活蛋白,Mouse IgG1 anti-Human,WB/IP
金纳米团簇碳纳米管血红蛋白
壳聚糖-磷酸钙/重组人骨形态发生蛋白2复合材料
人血清蛋白-无机纳米复合材料
氧化石墨烯重组链球菌蛋白G复合物材料
羊毛角蛋白/氧化石墨烯复合材料
基于金属—有机骨架材料及石墨烯的C-反应蛋白
zzj 2021.3.25




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询