mPEG-TK-DOX(甲氧基聚乙二醇-硫醚键-阿霉素)
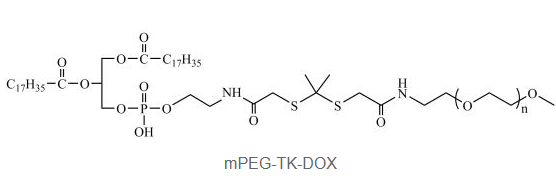
mPEG-TK-DOX 是以TK连接基团将阿霉素(DOX)与mPEG共价偶联形成的前药共轭物。其结构在氧化应激(如肿瘤微环境)条件下,TK键断裂,释放活性DOX,从而增强肿瘤选择性杀伤。该结构克服了传统DOX的系统毒性问题,提升了其治疗指数,适用于构建前药型纳米粒、胶束等智能释药系统。
一、产品基础信息与结构分析
中文名称:甲氧基聚乙二醇-硫醚键-阿霉素
英文名称:mPEG-TK-DOX
别称:ROS响应型聚乙二醇-阿霉素前药、硫醚连接的阿霉素PEG化前体、氧化应激诱导可断裂聚合物药物共轭物
分子组成:mPEG-TK-DOX 由三部分构成:
mPEG(Methoxy polyethylene glycol):亲水性聚合物,起到延长血液循环时间、提高水溶性、减少毒副作用的作用;
TK(Thioketal)键:一种对**活性氧(ROS)**高度敏感的化学连接体,可在氧化应激环境中断裂;
DOX(Doxorubicin):阿霉素,是一种广泛用于癌症化疗的蒽环类*肿瘤抗生素。
连接方式:
阿霉素通过其酚羟基(C14位)或氨基(C3位)与TK基团共价连接;
TK基团通过酯键或酰胺键与mPEG结合;
结果形成稳定的、在正常生理条件下不释放药物、但在ROS环境中快速降解的小分子或聚合物前药(polymeric prodrug)。
mPEG-TK-DOX 的主要特性:
功能结构 | 生理功能 |
mPEG | 提高水溶性、延长血液循环时间、降低免疫原性 |
TK键 | ROS触发的响应性释放机制,确保药物在病灶释放 |
DOX | 提供强效*癌活性(干扰DNA复制) |
二、功能机制与刺激响应特性
1. ROS响应性机制
Thioketal键是基于两个硫原子与中心羰基构成的结构,其特点是:
对过氧化氢(H₂O₂)、羟自由基(·OH)、超氧阴离子(O₂⁻)等ROS物质特异性断裂;
在中性pH和常规生理环境下稳定;
在肿瘤、炎症、缺血组织等高氧化应激微环境中快速断裂。
mPEG-TK-DOX 进入体内后通常表现为:
在血液循环中,PEG段保护DOX不被提前释放;
纳米粒或前药通过EPR效应或靶向机制进入肿瘤组织;
肿瘤细胞内ROS浓度远高于正常细胞(可达50–100 µM),触发TK键断裂;
阿霉素从mPEG载体上解离出来,进入细胞核,干扰DNA复制、诱导细胞凋亡。
2. 释放行为的可控性
稳定性强:在pH 7.4的缓冲液中,mPEG-TK-DOX稳定存在72小时以上;
响应速度快:在50 μM H₂O₂环境中,4小时内释放超过60%的DOX;
释药位点精准:仅在肿瘤或炎症组织中释放,降低全身毒性。
3. 药代动力学优势
清除率降低:mPEG保护使得前药半衰期延长;
肝肾负担减少:较少的自由DOX进入正常组织;
血脑屏障穿透能力增强:有研究采用mPEG-TK-DOX用于脑瘤模型,改善BBB穿透性。
三、合成方法与质量控制
1. 合成路线简述:
原料:
mPEG-OH(通常为分子量 2K–5K)
TK二羧酸或TK-NHS酯
Doxorubicin HCl
合成步骤:
① mPEG-TK合成
将mPEG-OH与TK二羧酸通过DCC/NHS或EDC/NHS酯化反应连接,获得mPEG-TK;
② TK-DOX连接
将TK部分活化为NHS酯,或使用碳二亚胺活化后,与DOX反应连接得到TK-DOX;
③ 纯化与表征
使用透析(MWCO 1–3 kDa)、HPLC或SEC纯化;
表征工具包括:
NMR:验证各部分结构;
MALDI-TOF MS:测定分子量;
UV-Vis:监测DOX吸收波长(480 nm);
HPLC:评估结合率与纯度;
DLS(动态光散射):用于粒径分析(如制备为胶束或纳米粒状态);
药物释放曲线:检测在不同ROS浓度下DOX的释放行为。
四、典型应用场景
1. 肿瘤精准化疗
mPEG-TK-DOX 是*肿瘤治疗中*具代表性的前药策略之一,用于以下肿瘤类型:
乳腺癌(尤其HER2+型)
肝癌
胰腺癌
卵巢癌
多发性骨髓瘤
脑瘤(如胶质母细胞瘤)
优点:
避免DOX在心肌、肾脏等正常器官中释放,减少心毒性;
实现“肿瘤特异性释药”;
可通过共装载策略与抗PD-1、CD47等免疫药物协同治疗。
2. 胶束或纳米粒载体平台
将mPEG-TK-DOX进一步构建为聚合物胶束系统,可增强其水溶性与体内分布性能。其结构为:
疏水核心:DOX段;
疏水-亲水界面:TK键;
外层亲水壳:mPEG
此类胶束尺寸通常在50–100 nm,有利于通过肿瘤EPR效应被动靶向进入肿瘤组织。
3. 多功能药物递送系统构建平台
mPEG-TK-DOX可作为核心结构,与以下功能基团共修饰以构建多功能平台:
RGD、GE11 等靶向肽;
pH敏感连接器,实现多重响应释放;
磁性Fe₃O₄或光热材料共封装,实现诊疗一体;
siRNA共装载系统,实现化疗+基因沉默协同。
五、未来发展前景与研究挑战
1. 发展趋势
多刺激响应系统整合:如pH + ROS + 酶等多重刺激响应;
免疫疗法协同:mPEG-TK-DOX与PD-L1抗体、TLR激动剂共装载;
精准化靶向设计:通过接枝GE11、folate、transferrin等肿瘤靶向配体;
跨越血脑屏障应用:脑肿瘤、神经胶质瘤中的定点治疗探索;
绿色合成:采用酶促合成、无金属催化方法提升生物相容性;
前药纳米疫苗平台:结合抗原+前药递送一体化设计,实现癌症免疫化疗协同。
2. 研究挑战
问题 | 描述 |
药物结合率控制 | 合成中TK-DOX连接效率较低,需优化反应条件 |
副产物清除难度 | 合成中存在自由DOX、未反应PEG等需彻底去除 |
生物降解产物安全性 | TK断裂后的硫化副产物在体内的毒理研究有限 |
工艺放大 | 前药聚合物的工业级制备仍面临成本与重复性问题 |
药效稳定性 | TK键稳定 |
关于我们 :
西安齐岳生物科技有限公司是一家专注于生物医药和纳米材料研发、生产与销售的高新技术企业。公司致力于为科研院所、高校以及医药企业提供高品质的生化试剂、功能材料和定制化服务。主要产品涵盖蛋白质/多肽类纳米材料、靶向药物递送系统、脂质体包封材料、PEG修饰载体、荧光探针、量子点等,广泛应用于药物研发、分子影像、细胞标记及诊疗一体化等领域。公司支持定制合成与技术支持服务,满足客户多样化科研需求。
相关产品:
IIA@SA-CS复合微球,丹参酮IIA@壳聚糖-海藻酸钠微球
温敏性壳聚糖-海藻酸钠-NIPAAm 微球 SA-CS-NIPAAm
双载药多功能海藻酸钠支架(IBU-PLLAms@SA/HAp-ALN)
包埋载药颗粒的多功能海藻酸钠支架(HAp-PLLAms@SA-Sr2+)
双重载药的多功能海藻酸钠支架
载嘧菌酯/海藻酸钠核壳结构微球
海藻酸钠基pH响应性聚合物胶束
海藻酸钠水凝胶微球包埋量子点和酶 Alg@QDs-UOx MSs
海藻酸钠与MOFs复合材料(Alg-HKUST-1)微球
海藻酸钠-矢车菊素-3-O-葡萄糖C3G自组装颗粒
CaCO3/DNA-海藻酸钙复合水凝胶




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询