葫芦脲类化合物(CBn,n=5–8,10)的超分子主客体复合物的生物成像
葫芦脲类化合物(CBs,n=5–8,10)是大环主体分子。近年来,越来越多的基于CB的超分子体系被报道,并应用于荧光开关、催化和细胞成像。对于荧光客体分子,主客体配合物通常会影响客体分子在CB腔内的电荷转移和聚集过程,并导致可调控的光物理性质,如波长偏移和发射增强。作为客体的染料分子的紫外-可见光谱和荧光光谱中的位移可用于生物成像和光热疗法。
葫芦脲CBs作为宿主可能提供一种新的的策略,将传统染料的吸收扩展到长波区。三苯胺衍生物已被证明是一种很好的双光子吸收材料,在传感和生物成像领域有着广泛的应用。作为给体基团,它们在不同的给体/受体体系中表现出分子分子内电荷转移
本文中选择水溶性三苯胺衍生物(乙烯基吡啶三苯胺)(1)作为客体分子。客体1在水溶液中通过主客体相互作用与CB[7]或CB[8]形成1_CB[7]或1_CB[8]配合物。对于1_CB[7]配合物,客体分子的三个带正电的吡啶位点被封装在三个CB[7]的空腔中以形成[1+3]配合物,而三个CB[8]作为主体和两个1作为客体的[2+3]主客体配合物(二聚体)通过头对头堆积(图1)。CBs的存在导致主客体配合物的紫外-可见光谱和荧光光谱比客体分子本身明显红移,这使其成为生物标记应用的合适候选者。值得注意的是,配合物结构的不同导致选择性染色细胞的不同区域。
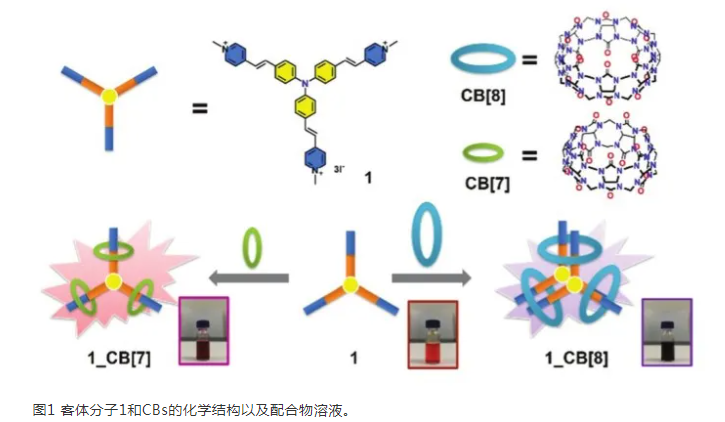
三个乙烯基吡啶通过偶连反应连接到三苯胺上,再通过甲基化将疏水性吡啶转化为亲水性吡啶,这为在水中形成1和CBs配合物提供了必要的条件。
我们先通过核磁滴定研究1_CB[7]和1_CB[8]在水中的形成。测定了配合物在不同配比下的核磁共振氢谱(图2)。随着CBs的增加,单体1的信号逐渐消失,同时出现了一组新的信号。当化合物1和CB[7]的比例达到1:3时,原始信号完全消失(图2a)。当1和CB[8]的比率达到2:3时,谱图中新出现的一组峰趋于稳定。同时,过量的CBs不会引起谱图的**变化。作者推测得到了1_CB[7]和1_CB[8]的结构。
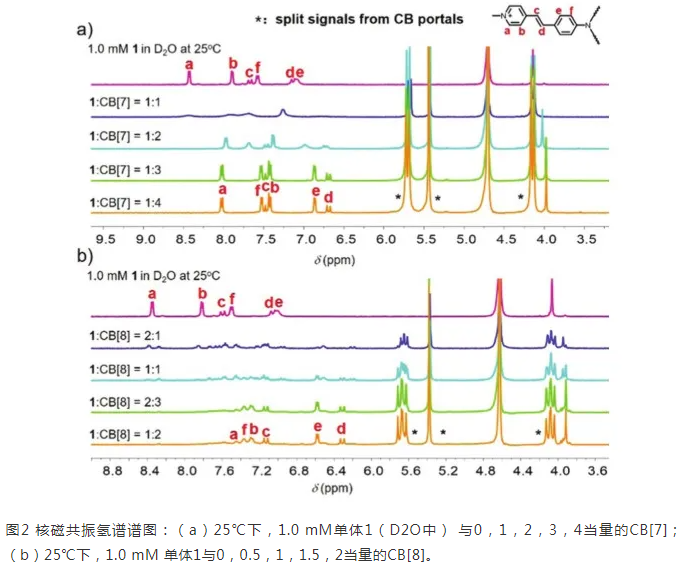
然后对1_CB[7](1:3)和1_CB[8](2:3)的配合物进行了浓度相关研究。结果表明配合物非常稳定,不依赖于浓度。作者认为客体分子与CB[7]形成[1+3]配合物,与CB[8]形成[2+3]配合物。通过电喷雾质谱(ESI-MS)、等温滴定量热法(ITC)实验进一步研究了1和CBs之间的结合行为,结果表明1_CB[7]的化学计量比为1:3,1_CB[8]的化学计量比为2:3。
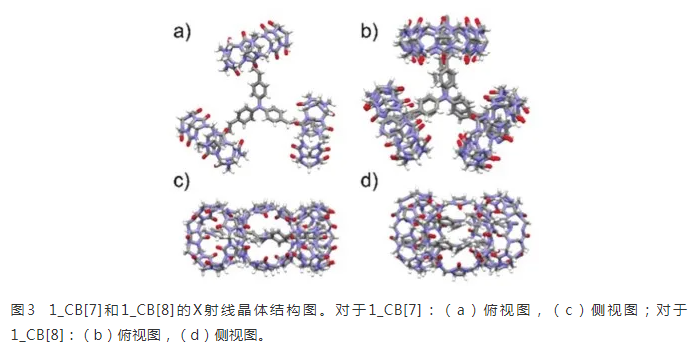
该主客体配合物可以通过缓慢冷却接近饱和的配合物水溶液来结晶。主客体配合物的晶体学数据可用CCDC 2059161(1_CB[7])和2036099(1_CB[8])。对于1_CB[7],单晶属于P63/m空间群,晶胞参数a=29.82Å,b=29.82Å,c=18.07Å,α=90°,β=90°,γ=120°。由于CB[7]的空腔相对较小,因此它只能容纳客体分子的一个乙烯基吡啶臂以形成[1+3]配合物(图3a和c)。对于1_CB[8],单晶属于C2221空间群,晶胞参数a=33.50Å,b=46.82Å,c=85.24Å,a=90°,β=90°,γ=90°。如图3b和d所示,两个分子1在CB[8]的帮助下以头对头堆积形成二聚体。两个分子之间的距离约为4.4 Å. 三个CB[8]分子位于六个乙烯基吡啶臂的末端,这是由于吡啶具有**的亲水作用。单体1中的两个吡啶部分被封装在一个CB[8]的空腔中,形成[2+3]配合物。单晶分析结果与核磁共振滴定结果高度一致。此外,CBs与客体分子之间形成配合物的过程会影响客体分子的耦合度和杂化能带结构,导致不同的电荷转移行为。因此,将产生不同的光物理性质。
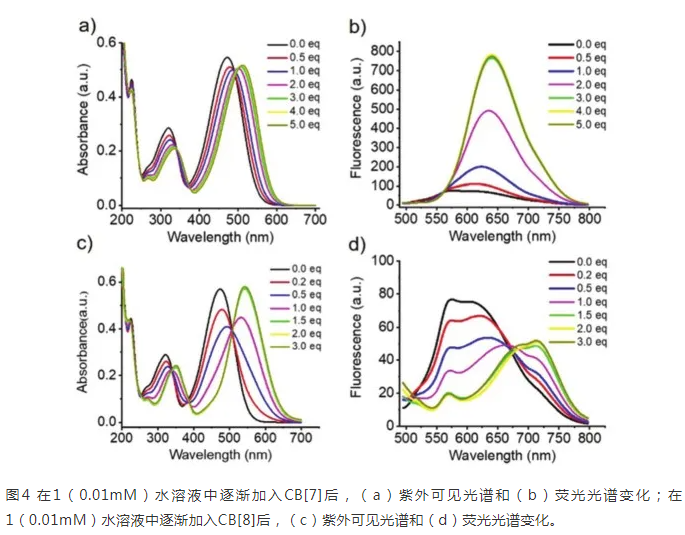
利用紫外-可见吸收光谱和荧光发射光谱进一步研究了1,1_CB[7]和1_CB[8]的光物理性质。随着CBs的加入,可以观察到**的变化,这进一步证明了CBs与水溶液中1的强相互作用。如图4所示,1显示了472 nm处的主吸收峰和572 nm处的荧光峰。随着CB[7]的加入,紫外-可见吸收峰从472 nm移动到506 nm(Δ=34 nm),荧光发射峰从572 nm移动到635 nm(Δ=63 nm),荧光强度增加了10倍。对于CB[8],紫外-可见吸收峰从472 nm移动到543 nm(Δ=71 nm),荧光发射峰从572 nm移动到714 nm(Δ=142 nm)。与1_CB[7]相比,1_CB[8]的紫外可见光谱和荧光光谱发生了更**的变化。溶液的颜色从橙色(1)变为深红色(1_CB[7]),紫色(1_CB[8])(图1)。造成这种现象的原因可能是,主体CBs中羰基的拉电子效应可以中和吡啶的正电荷,这使得吡啶从三苯胺基团中吸收的电子增加,从而导致吸电子和拉电子效应增强。因此可能导致光谱红移。同时,较大的CB[8]能将两个客体分子包埋在空腔中,使客体分子稳定聚集形成配合物,从而限制了分子的旋转。
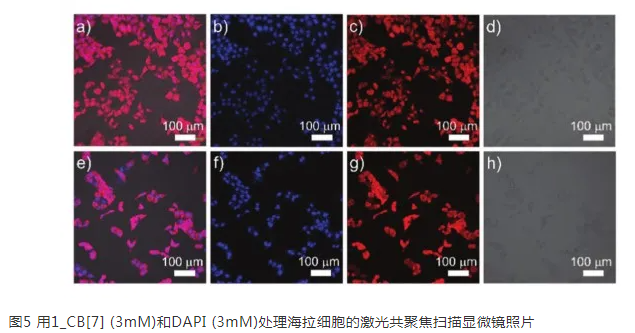
吡啶衍生物在核酸化学中已被证实具有生物活性。分子动力学模拟也证实了吡啶与DNA的结合。客体分子中阳离子吡啶的存在,通过与糖-磷酸主链的静电相互作用,确保了对DNA的强亲和力。考虑到配合物的荧光发射特性和与DNA的亲和性,作者进一步研究了配合物作为荧光染料在细胞成像中的应用。为了检测复合物对细胞的染色性能,分别用1_CB[7]和1_CB[8]水溶液处理海拉细胞。如图5a-d所示,1_CB[7]在细胞的细胞核和细胞质中都有强烈的发射,说明1_CB[7]配合物可以穿透细胞并与DNA结合。用4',6-二脒基-2-苯基吲哚(DAPI)进行的对照实验显示了细胞核的彩色位置(图5a和b)。对于1_CB[8]配合物,荧光主要分布在细胞质区域,而在绿光(561 nm)激发下的细胞核中几乎看不到辐射(图5g)。同时对客体1的染色性能进行对照实验。结果清楚地表明,客体1只能染色细胞核。这说明1,1_CB[7]和1_CB[8]配合物具有良好的细胞通透性和细胞显像性能。对于1_CB[8]配合物,714nm处的荧光使其适合于荧光细胞染色。动态光散射(DLS)分析表明,1_CB[7] (0.78 nm)和1_CB[8] (2.31 nm)的粒径不同。考虑到1,1_CB[7],1_CB[8]在细胞不同染色区域(从细胞核到细胞质)的规律性变化,客体分子和配合物的大小可能是控制细胞染色区域的关键因素。采用MTT法对配合物的细胞活力进行了定量分析,表明该配合物具有较好的生物相容性和较低的du性。
温馨提示:西安齐岳生物科技有限公司供应的产品仅用于科研,不能用于人体和其他商业用途axc




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询