间充质干细胞(MSCs)已成为肾脏疾病的潜在**物,胶质细胞源性神经营养因子(GDNF)已被证明可促进MSCs改善肾损伤的**作用。近日,来自徐州医科大学附属医院肾内科孙东课题组的研究人员在Theranostics杂志上发表文章,揭示了GDNF修饰的人脂肪间充质干细胞衍生的外泌体通过激活SIRT1 / eNOS信号通路,改善了肾小管间质纤维化的肾小管周围的毛细血管丢失。该研究展示了外泌体途径促进肾脏微血管损伤中血管生成的新理论。
慢性进行性肾纤维化导致许多慢性肾病患者的终末期肾功能衰竭,影响着**数十亿人。进行性肾小管间质纤维化是导致慢性肾功能衰竭的常见途径。在动物模型和患者中,所有的肾脏疾病均与肾小管周围毛细血管(PTC)丢失有关。因此,PTC减少并导致慢性肾组织缺氧的肾微血管损伤是肾纤维化的**特征。在此背景下,确定延缓肾纤维化的新靶点、帮助稳定PTCs、清除凋亡细胞和促进毛细血管再生非常重要。
从包括肾、脂肪组织和脐带在内的各种来源的间充质干细胞(MSC)是具有强大自我更新功能、再生功能、促血管生成功能和免疫调节特性,这些多分化潜能的多能细胞可以作为肾脏再生**的理想候选细胞。研究团队此前发现,人羊水来源的干细胞能够在单侧输尿管梗阻(UUO)后归巢于PTCs,并通过增加肾脏微血管密度来减轻肾间质纤维化。胶质细胞源性神经营养因子(GDNF)是一种保护黑质多巴胺能神经元的**神经营养因子。GDNF预处理后,能够增强人羊水来源的干细胞再生潜力。此外,GDNF工程化的人羊水衍生干细胞在肾脏损伤中起保护作用。但是,对该过程的详细机制目前了解甚少。
对MSC促进新血管生成的分子机制的分析表明,分泌的因子(如外泌体)是与局部和远处组织通信的关键参与者。MSC是外泌体的生产者,外泌体是内体来源的30-100 nm大小的小膜状颗粒,其携带mRNA、microRNA和蛋白质,并通过转移内源性分子并调节受损细胞的凋亡、炎症、纤维化和血管生成而发挥保护作用。实际上,在急性肾衰竭的实验啮齿动物模型中,已经证明了源自MSC的外泌体的递送通过mRNA依赖性机制恢复了肾脏的结构和功能。MSC来源的外泌体可通过改善UUO肾脏中的PTC密度来防止肾脏损伤。然而, GDNF是否介导MSC来源的外泌体的旁分泌作用来保护肾脏免受UUO损伤,此前还不清楚。
Sirtuin 1(SIRT1)是NAD +依赖性去乙酰化酶,通过**细胞凋亡、炎症和纤维化发挥细胞保护作用。在肾脏中,SIRT1可能**肾细胞凋亡、炎症和纤维化,有助于维持肾脏的稳态。血管生成是SIRT1和内皮型一氧化氮合酶(eNOS)之间相互作用调节的功能之一。但是,尚不清楚血管生成调节因子SIRT1是否在CKD的发生中起作用。同样,与源自GDNF修饰的人脂肪间充质干细胞的外泌体(GDNF-AMSC-exo)相关的肾脏保护作用的潜在机制仍有待确定。
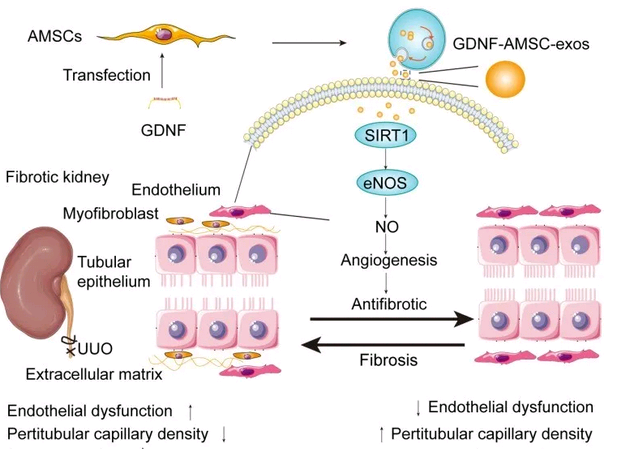
在本研究中,研究人员从表达GFP的脂肪间充质干细胞(GFP-AMSCs)和GDNF修饰的人脂肪间充质干细胞(GDNF-AMSCs)中分离出外泌体(分别为GFP-AMSC-exos和GDNF-AMSC-exos)。结果显示,PKH67绿色荧光标记的外泌体在UUO肾脏中可见,并与CD81共定位。GDNF-AMSC-exos**降低了UUO小鼠的PTC稀疏性和肾纤维化评分。体外研究表明,GDNF-AMSC-exos通过刺激迁移和血管生成并赋予细胞凋亡抗性,发挥细胞保护作用。机制上,GDNF-AMSC-exos增强了SIRT1信号传导,并伴随着p-eNOS水平的提高。研究人员还通过免疫沉淀证实了HUVEC中SIRT1-eNOS的相互作用。此外,体内PTC数与SIRT1表达水平呈现相关性。这项研究揭示了外泌体改善肾纤维化的机制,即GDNF-AMSC-exos可能通过激活SIRT1 / eNOS信号通路来激活存活的PTC中的血管生成程序。
以上内容均来自网络,如有侵权,请联系在在线客服删除!谢谢
不用于商业用途用途,不能用于人体实验




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询