多肽修饰的脂质体载药纳米颗粒定制合成技术及案例
一、综述
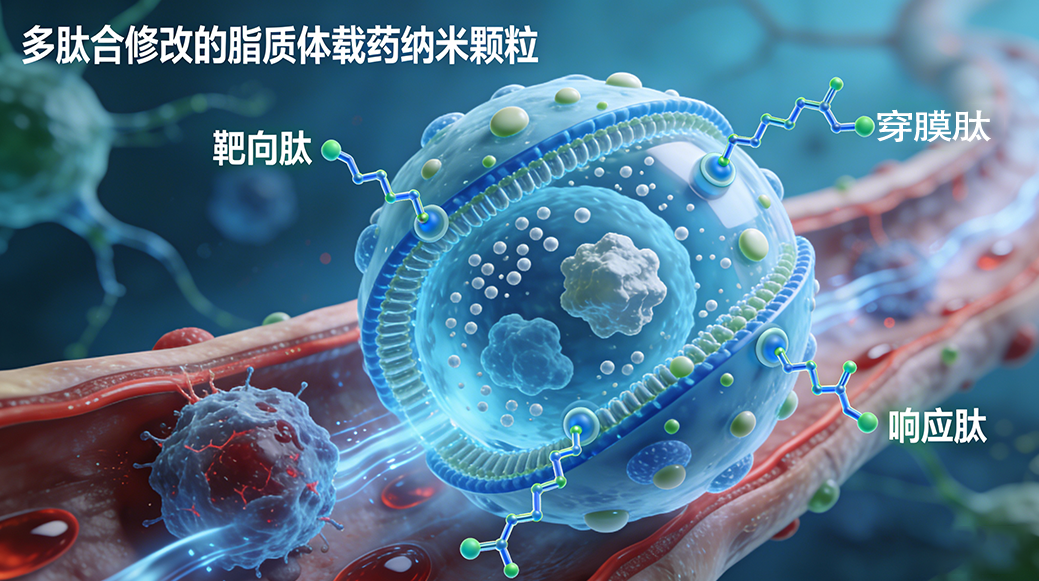
多肽修饰脂质体载药纳米颗粒,结合脂质体生物相容、高包封特性与多肽靶向、低免疫优势,攻克传统化疗痛点,赋能肿瘤、炎症精准治疗。西安齐岳生物提供多种药物适配、多种多肽修饰、多类型载体定制及靶向型、响应型、多药共载型、诊断-治疗一体化型、跨屏障型等全流程技术服务,助力科研转化。
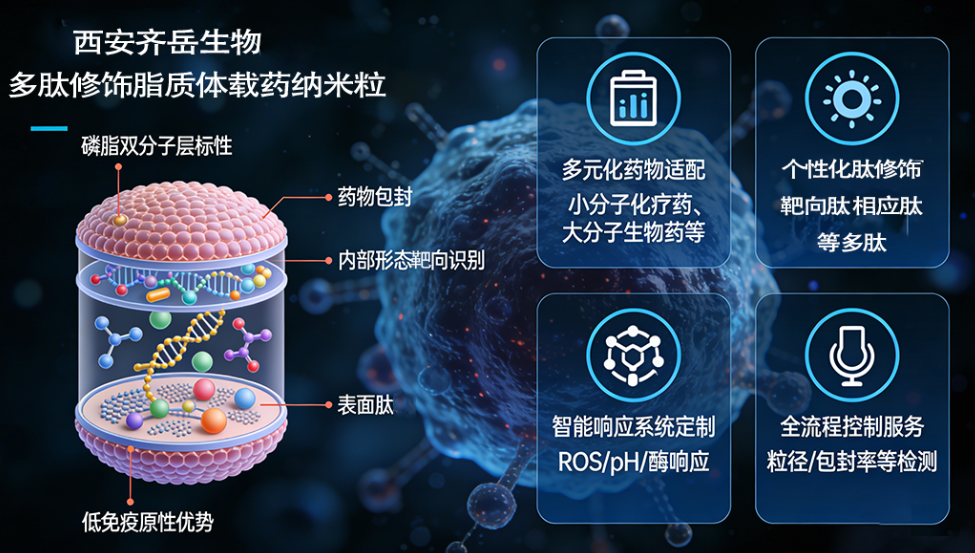
二、西安齐岳生物定制合成服务详情(综合表格)
| 核心类别 | 具体分类/项目 | 详细内容 | 关联应用/说明 |
| 1、适配药物种类 | 小分子化疗药物 | 阿霉素、紫杉醇、多西他赛、顺铂、卡铂、5-氟尿嘧啶、甲氨蝶呤、依托泊苷等 | 肿瘤常规化疗 |
| 靶向小分子药物 | 吉非替尼、厄洛替尼、索拉非尼、瑞戈非尼等酪氨酸激酶抑制剂 | 精准靶向肿瘤治疗 | |
| 大分子生物药物 | 胰岛素、生长因子、单克隆抗体片段、核酸药物(siRNA、miRNA、DNA疫苗)、多肽药物(亮丙瑞林、生长抑素)等 | 生物治疗、基因治疗 | |
| 抗炎/免疫调节药物 | 地塞米松、环孢素A、雷帕霉素等 | 炎症性疾病、免疫调节治疗 | |
| 2、常用修饰多肽种类 | 靶向多肽 | 1. 整合素靶向肽:RGD肽(c(RGDyK)、RGDfV); 2. EGFR靶向肽:GE11肽(YHWYGYTPQNVI); 3. HER2靶向肽:H20肽(KCCYSL)、AHNP肽; 4. 肿瘤新生血管靶向肽:NGR肽(Asn-Gly-Arg); 5. 脑靶向肽:TAT肽片段、Angiopep-2肽 | 组织/细胞特异性靶向递送 |
| 细胞穿透肽(CPPs) | TAT肽(YGRKKRRQRRR)、穿膜肽(Penetratin)、R8肽 | 增强细胞膜穿透性,提升胞内药物浓度 | |
| 响应型多肽 | 1. ROS响应肽:含硫醚键/硒醚键/芳香环多肽(CP1 peptide); 2. 酶响应肽:MMPs响应肽(GPLGLAG肽)、组织蛋白酶响应肽; 3. pH响应肽:含组氨酸多肽(H5肽、H6肽) | 病灶微环境精准触发药物释放 | |
| 功能化多肽 | 荧光标记肽(FITC-RGD、Cy5-TAT)、生物素修饰肽 | 体内外追踪、表征验证 | |
| 3、修饰与载药核心技术流程 | 多肽预处理与修饰适配 | 根据多肽特性进行末端修饰(氨基化、羧基化、巯基化);通过共价键(酰胺键、二硫键)或非共价键(静电/疏水作用)与膜材结合;敏感多肽低温避光预处理 | 保障多肽生物活性与修饰稳定性 |
| 脂质体载体制备 | 膜材选择:DSPC、DPPC、胆固醇、PEG化脂质等; 制备方法:薄膜分散法、逆向蒸发法、乙醇注入法、高压均质法; 粒径调控:50-200nm可调 | 适配不同药物特性,优化载体分散性 | |
| 多肽修饰与药物负载 | 1. 主动载药:水溶性药物(阿霉素、顺铂)采用pH梯度法、硫酸铵梯度法; 2. 被动载药:脂溶性药物(紫杉醇、多西他赛)采用薄膜分散/逆向蒸发法; 3. 多肽修饰:适宜pH/温度孵育,共价/非共价结合,修饰密度10-100个多肽分子/脂质体 | 提升包封率,实现精准修饰 | |
| 产品表征与优化 | 基础表征:粒径分布(DLS)、Zeta电位、包封率/载药量、多肽修饰率、TEM形貌观察;性能验证:血清/pH稳定性、体外释放试验、靶向性验证(细胞摄取/迁移侵袭试验) | 确保产品符合定制需求与科研应用标准 | |
| 4、定制核心细分方向 | 靶向型、响应型、多药共载型、诊断-治疗一体化型、跨屏障型 | 可根据药物特性、治疗需求、靶向位点设计个性化方案 | 覆盖肿瘤、炎症、中枢神经系统疾病等科研需求 |
三、定制合成服务应用场景汇总表
| 定制方向 | 适配药物类型及代表药物 | 可选修饰多肽 | 核心制备技术 | 关键表征指标 | 应用场景 |
| 1、靶向型多肽修饰脂质体 | 小分子化疗药(阿霉素、紫杉醇)、靶向药(吉非替尼)、核酸药物;代表:阿霉素-RGD修饰脂质体 | RGD肽、GE11肽、NGR肽、Angiopep-2肽 | 薄膜分散法+pH梯度主动载药;多肽共价偶联修饰 | 粒径50-150nm;Zeta电位-20~-10mV;包封率≥85%;修饰率≥80%;细胞靶向摄取率提升2-5倍 | 肿瘤精准化疗(肺癌、乳腺癌、脑肿瘤等) |
| 2、ROS响应型多肽修饰脂质体 | 化疗药(多西他赛、顺铂)、抗炎药(地塞米松);代表:多西他赛-ROS响应肽修饰脂质体 | CP1肽、含硫醚键响应肽 | 逆向蒸发法+被动载药;响应肽与PEG脂质共修饰 | 粒径80-200nm;ROS环境下24h药物释放率≥70%;血清稳定性≥72h;包封率≥80% | ROS高表达肿瘤(肝癌、结直肠癌)、炎症性疾病(类风湿关节炎) |
| 3、多药共载多肽修饰脂质体 | 化疗药+靶向药(阿霉素+索拉非尼)、化疗药+免疫调节剂(紫杉醇+雷帕霉素) | RGD肽、TAT肽(穿透+靶向双功能) | 高压均质法+梯度载药(水溶性药)+被动载药(脂溶性药) | 双药包封率均≥80%;粒径均一(CV≤0.2);体外协同杀伤率提升30%以上 | 肿瘤联合治疗,降低耐药性 |
| 4、诊断-治疗一体化多肽修饰脂质体 | 化疗药(紫杉醇)+荧光造影剂(FITC)、核酸药物+MRI造影剂(Gd-DTPA) | FITC-RGD肽、生物素修饰靶向肽 | 乙醇注入法+药物/造影剂共载;多肽荧光标记修饰 | 荧光强度稳定;造影信号清晰;靶向成像信噪比提升4-6倍;包封率≥85% | 肿瘤术中导航、治疗效果实时监测 |
| 5、跨屏障多肽修饰脂质体 | 神经药物(多巴胺)、脑部肿瘤药(替莫唑胺)、核酸药物(siRNA) | Angiopep-2肽、TAT肽 | 薄膜分散法+主动载药;多肽与PEG共修饰提升屏障穿透性 | 血脑屏障穿透率提升3-5倍;脑部药物浓度增加40%以上;粒径≤100nm | 脑部肿瘤、阿尔茨海默病、帕金森病等中枢神经系统疾病 |
四、多肽修饰的脂质体载药纳米颗粒定制技术优势
西安齐岳生物在多肽修饰的脂质体载药纳米颗粒定制领域具备全面的技术优势,依托成熟的研发体系、精准的制备工艺及严格的质控标准,可稳定输出高性能定制产品,核心优势体现在以下五大维度:

五、定制合成案例展示
| 案例一:多肽修饰脂质体载药物阿霉素 | 案例二:多肽修饰ROS响应脂质体载药 |
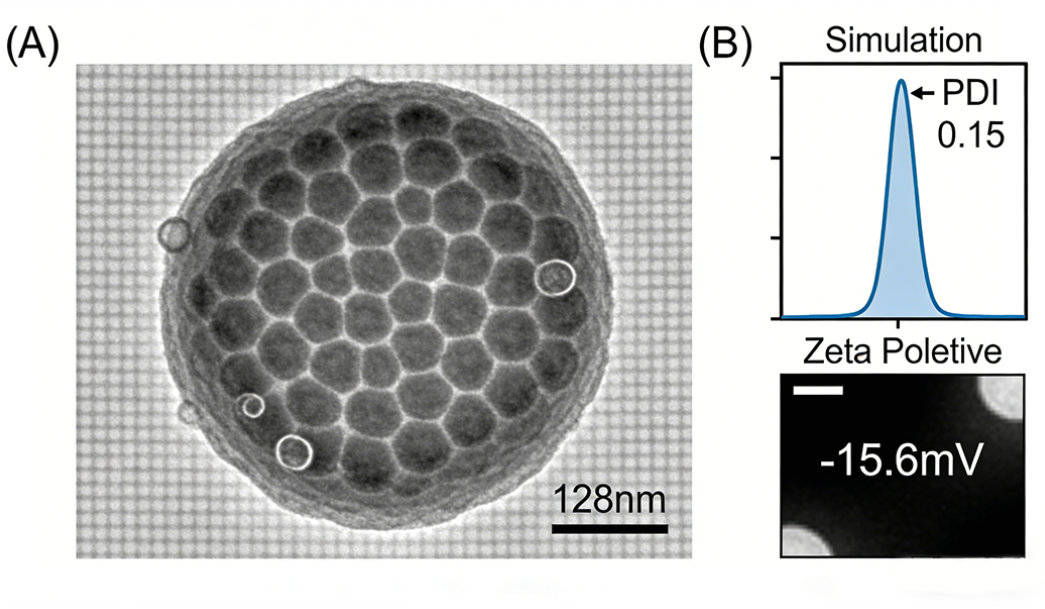
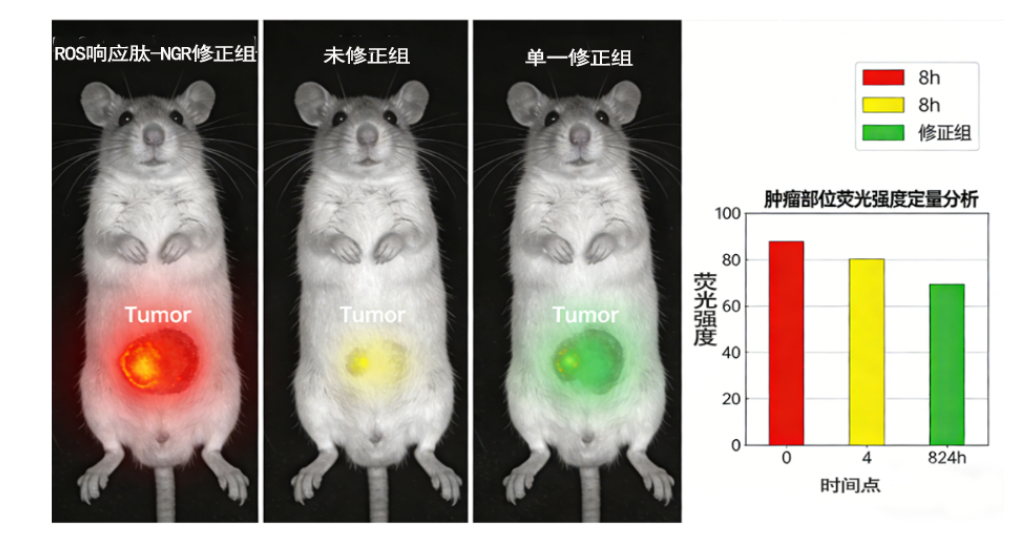
案例背景 客户需求:定制RGD肽修饰的脂质体载阿霉素(DOX),用于αvβ3整合素高表达的肺癌细胞靶向治疗研究,要求粒径100-150nm,包封率≥85%,具备良好的靶向性与体外抗肿瘤活性。 | 案例背景 客户需求:定制ROS响应型多肽修饰的脂质体载多西他赛(DTX),用于ROS高表达的肝癌(HepG2细胞)治疗研究,要求在正常生理环境(ROS浓度低)下药物缓慢释放,在肿瘤微环境(ROS浓度高,H₂O₂浓度100μM)下快速释放,多肽修饰后具有靶向性,粒径80-120nm。 |
案例结果(图文展示)
图1:RGD肽修饰脂质体载阿霉素的透射电镜(TEM)图 | 案例结果
体内分布实验(小动物活体成像,裸鼠荷HepG2肿瘤模型) |
六、相关参考文献
1. 中文名:多肽修饰脂质纳米颗粒增强RNA疗法的抗肿瘤 efficacy
英文名:Peptide-Modified Lipid Nanoparticles Boost the Antitumor Efficacy of RNA Therapeutics
链接:https://pubs.acs.org/doi/pdf/10.1021/acsnano.4c14625
主要内容:
针对脂质纳米颗粒(LNPs)全身给药后易非特异性蓄积于肝脏、抗肿瘤疗效有限的问题,将CD44特异性靶向肽A6通过PEG偶联到LNPs的胆固醇上构建AKPC-LNP,实现肿瘤特异性递送。该修饰在体外和体内均显著提升了对乳腺癌细胞的递送效率,进一步将其负载靶向YAP/TAZ的siRNA,在2D培养和3D肿瘤球中均实现强效基因沉默和细胞死亡增加,效果优于未修饰LNPs。在乳腺癌细胞异种移植斑马鱼模型中,AKPC-siYAP可有效沉默YAP/TAZ及其下游基因,显著增强肿瘤抑制效果;在前列腺癌类器官和患者来源异种移植(PDX)模型中,也能有效抑制增殖和肿瘤生长,为靶向癌症治疗的RNA疗法递送系统提供了高效方案。
2. 中文名:糖肽修饰pH敏感脂质体的制备及其促进抗原交叉呈递和诱导抗原特异性细胞免疫的作用
英文名:Preparation of glycopeptide-modified pH-sensitive liposomes for promoting antigen cross-presentation and induction of antigen-specific cellular immunity
链接:https://pubs.rsc.org/it-it/content/articlepdf/2024/bm/d3bm01746j
主要内容:
抗原交叉呈递(外源性抗原呈递至抗原呈递细胞的MHC I类分子)对癌症免疫治疗和感染性疾病治疗至关重要。为避免直接将甘露糖残基引入pH响应多糖导致脂质体胞质递送性能受抑的问题,本研究将含甘露糖的聚糖单独整合到pH响应多糖修饰的脂质体中,采用大豆凝集素衍生糖肽作为抗原呈递细胞上凝集素的配体。糖肽的整合显著提高了树突状细胞系对脂质体的摄取量和交叉呈递效率,同时负载糖肽和pH响应多糖的脂质体在体外具有强佐剂效应,可诱导脾脏中树突状细胞、M1巨噬细胞和效应T细胞增加;皮下给药可诱导抗原特异性细胞免疫,在荷瘤小鼠中产生强效治疗效果,为制备基于脂质体的纳米疫苗实现抗原交叉呈递和诱导细胞免疫用于癌症治疗提供了有效策略。
3. 中文名:Self肽与Tat肽协同修饰阿霉素脂质体的制备及其抗肿瘤作用
英文名:Preparation and antitumor effects of Self and Tat peptide co-modified doxorubicin liposomes
链接:http://m.qikan.cqvip.com/article/ArticleDetail?id=7201662035
主要内容:
为提高Tat肽修饰脂质体的免疫生物相容性和内皮细胞渗透性,进而提升其包载阿霉素后的抗肿瘤疗效,采用薄膜水化法制备常规脂质体(Lip)、Self肽修饰脂质体(S-Lip)、Tat修饰脂质体(T-Lip)及双肽共修饰脂质体(ST-Lip),通过主动载药法包载阿霉素。表征结果显示,多肽修饰未显著改变脂质体形貌与粒径,各组药物包封率均>80%。体外实验表明,ST-Lip相较T-Lip显著抑制巨噬细胞内吞;体内免疫识别结果显示,ST-Lip组脾脏巨噬细胞和B细胞的脂质体阳性比例相比T-Lip分别降低约16.7%及39.0%。此外,Self肽与Tat肽产生协同效应,使内皮细胞摄取量相比Lip提高1.77倍,对荷瘤小鼠抑瘤率达87%。研究证实CD47衍生Self肽可协同增强Tat修饰脂质体的免疫相容性及内皮细胞渗透能力,为肿瘤靶向递送系统开发提供了新策略




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询